
题目列表(包括答案和解析)
(10分)随着人们日常生活水平的提高,室内空气污染越来越受到人们的重视。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡、一氧化碳等物质。
请回答下列问题:
⑴苯分子的结构简式为 。
⑵我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。某校化学研究性学习小组的同学通过查阅资料,拟采用如下方法测定某新装修居室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
实验操作:用容积为1000 mL的医用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如下),当酸性高锰酸钾溶液正好褪色时,停止注入。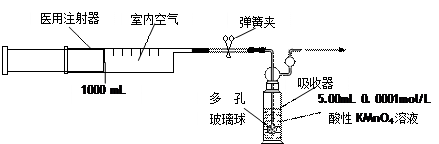
①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液1000mL,需0.1000mol/L的酸性KMnO4溶液的体积为 。
②向酸性高锰酸钾溶液中注入空气前,应检查吸收器装置气密性,操作方法为 ;装置中多孔玻璃球的作用是 。
③实验时在居室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第200次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液正好褪色。请通过计算说明该居室空气中甲醛含量是否超标(空气中其他成分不与酸性高锰酸钾溶液反应)。
④请你举出减少室内空气污染的一条合理措施: 。

(18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。
A.溶液显浅红色是因为Na2SO3水解呈酸性 B.水解反应为放热反应
C.水解反应为吸热反应 D.升高温度,Na2SO3水解程度增大
第二组:该小组讨论Fe3+和SO32-之间发生怎样的反应,提出了三种假设:①是发生氧化还原反应:2Fe3++SO32-+ H2O = 2Fe2++ SO42-+ 2H+;②是发生双水解反应:2Fe3++ 3SO32-+ 6H2O =2Fe(OH)3(胶体) + 3H2SO3;③是两种反应同时发生。为了验证假设,同学们进行了下列实验,请填写下列空白:
(1) 用试管取适量Na2SO3溶液,加入BaCl2稀溶液,有白色沉淀生成,再加稀盐酸,沉淀全部溶解,然后再进行后续实验。该实验操作的目的是______________________。
(2) 取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3溶液至过量,溶液颜色最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中加足量盐酸,将所得溶液分成两份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为________________________;另一份加入BaCl2稀溶液,产生少量白色沉淀,白色沉淀为________(填化学式)。
(3) 由上述实验现象说明假设__________(填编号)是正确的。
第三组:用0.1000mol/L的酸性KMnO4溶液滴定未知浓度的Na2SO3溶液,用碱式滴定管量取25.00mL Na2SO3溶液于锥形瓶,用_____式滴定管盛装KMnO4溶液进行滴定,滴定终点颜色变化为:_____色变为_____色;重复三次实验,测得消耗的KMnO4溶液体积平均值为20.00mL,则Na2SO3的浓度为____________mol/L。
(18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。
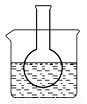
A.溶液显浅红色是因为Na2SO3水解呈酸性 B.水解反应为放热反应
C.水解反应为吸热反应 D.升高温度,Na2SO3水解程度增大
第二组:该小组讨论Fe3+和SO32-之间发生怎样的反应,提出了三种假设:①是发生氧化还原反应:2Fe3++SO32-+ H2O = 2Fe2++ SO42-+ 2H+;②是发生双水解反应:2Fe3++ 3SO32-+ 6H2O = 2Fe(OH)3(胶体) + 3H2SO3;③是两种反应同时发生。为了验证假设,同学们进行了下列实验,请填写下列空白:
(1) 用试管取适量Na2SO3溶液,加入BaCl2稀溶液,有白色沉淀生成,再加稀盐酸,沉淀全部溶解,然后再进行后续实验。该实验操作的目的是______________________。
(2) 取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3溶液至过量,溶液颜色最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中加足量盐酸,将所得溶液分成两份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为________________________;另一份加入BaCl2稀溶液,产生少量白色沉淀,白色沉淀为________(填化学式)。
(3) 由上述实验现象说明假设__________(填编号)是正确的。
第三组:用0.1000mol/L的酸性KMnO4溶液滴定未知浓度的Na2SO3溶液,用碱式滴定管量取25.00mL Na2SO3溶液于锥形瓶,用_____式滴定管盛装KMnO4溶液进行滴定,滴定终点颜色变化为:_____色变为_____色;重复三次实验,测得消耗的KMnO4溶液体积平均值为20.00mL,则Na2SO3的浓度为____________mol/L。
(18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。
| A.溶液显浅红色是因为Na2SO3水解呈酸性 | B.水解反应为放热反应 |
| C.水解反应为吸热反应 | D.升高温度,Na2SO3水解程度增大 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com