
题目列表(包括答案和解析)
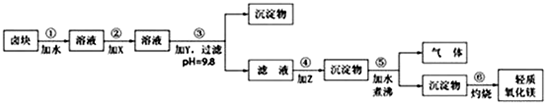
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
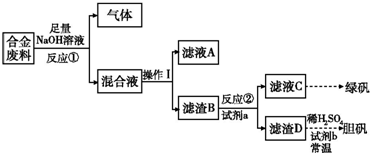
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
(10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+ 等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+ 等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3 可制得重要的催化剂MnO2,MnCO3 → MnO2 + CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是
kg。(摩尔质量/g·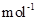 :MnCO3 115
MnO2 87 MnO 71)
:MnCO3 115
MnO2 87 MnO 71)
(10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+ 等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+ 等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3 可制得重要的催化剂MnO2,MnCO3 → MnO2+ CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是 kg。(摩尔质量/g·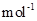 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com