
题目列表(包括答案和解析)
A.NaOH和H2SO4溶液的物质的量浓度相等
B.NaOH的物质的量浓度等于H2SO4物质的量浓度的两倍
C.NaOH和H2SO4溶液的质量分数相等
D.氢氧化钠溶液的pH和硫酸溶液的pH之和等于14
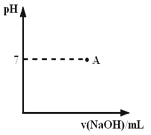
用氢氧化钠溶液来滴定硫酸溶液,当达到滴定终点时,消耗氢氧化钠溶液的体积等于锥形瓶中硫酸溶液的体积,则说明
[ ]
A.NaOH和H2SO4溶液的质量分数相等
B.NaOH和H2SO4溶液的物质的量浓度相等
C.NaOH的物质的量浓度等于H2SO4物质的量浓度两倍
D.氢氧化钠溶液的pH和硫酸溶液的pH之和等于14
用氢氧化钠溶液来滴定硫酸溶液,当达到滴定终点时,消耗氢氧化钠溶液的体积等于锥形瓶中硫酸溶液的体积,说明
[ ]
A.NaOH和H2SO4的质量分数相等
B.NaOH和H2SO4溶液的物质的量浓度相等
C.NaOH溶液的物质的量浓度等于H2SO4溶液物质的量浓度的两倍
D.氢氧化钠溶液的pH与H2SO4溶液的pH之和为14
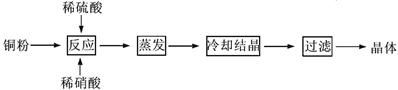
| H | + 4 |
| O | 2- 4 |
| O | - 3 |
| O | - 3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com