
题目列表(包括答案和解析)
(1)现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,
其正确的操作是________.纯碱溶液呈碱性的原因(用离子方程式表示)是________,你认为该溶液的pH的范围一定介于________之间.
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案.________.
A组问题:
(1)指出所选用的试剂(写编号)________。
(2)实验过程中有关反应的离子方程式________。
(3)简述你的操作步骤。
B组问题:
(1)试说明不能测定的原因________。
(2)指出需要补加的试剂名称________。
(3)简述你的操作步骤。
在一种烧碱溶液中混有少量纯碱(杂质浓度〈0.1mol•L-1)。某同学欲测定其中氢氧化钠的物质的量浓度。现有的药品和仪器有:药品:①0.10mol•L-1盐酸 ②0.10mol•L-1Ba(OH)2溶液 ③0.10mol•L-1BaCl2溶液④酚酞试液 ⑤甲基橙试液仪器:①铁架台(带滴定管夹) ②烧杯 ③酸、碱式滴定管 ④锥形瓶 ⑤玻璃棒 ⑥过滤装置根据现有的药品和仪器(量和规格均能满足要求),你认为能测定就只回答A组问题,认为不能测定就只回答B组问题。
A组问题:
(1)指出所选用的试剂(写编号)________。
(2)实验过程中有关反应的离子方程式________。
(3)简述你的操作步骤。
B组问题:
(1)试说明不能测定的原因________。
(2)指出需要补加的试剂名称________。
(3)简述你的操作步骤。
为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。
【问题1】工业生产碘酸钾的流程如下:
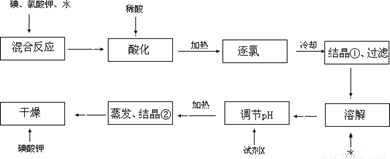
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该方程式配平时,系数有多组,原因是 。
(2)X的化学式为 ;写出用试剂X调节pH的化学方程式: 。
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响? 。
【问题2】已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O; I2+2S2O32-→2I-+S4O62-。
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL恰好反应。
则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。 |
溶液无变化 |
|
然后再滴入1滴1mol·L-1的H2SO4,振荡。 |
溶液变蓝色 |
①推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。
【问题1】工业生产碘酸钾的流程如下: 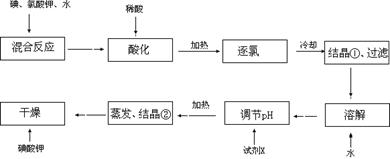
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该方程式配平时,系数有多组,原因是 。
(2)X的化学式为 ;写出用试剂X调节pH的化学方程式: 。
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响? 。
【问题2】已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O; I2+2S2O32-→2I-+S4O62-。
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL恰好反应。
则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol·L-1的H2SO4,振荡。 | 溶液变蓝色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com