
题目列表(包括答案和解析)
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+)>c (C6H5O-) >c(H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2 c (NH4+)= c (C6H5O-)+c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式 。
(6)Ⅰ.如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
① T1 T2(填>、=、<),
T2温度时Ksp(BaSO4)= ;
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
(14分)根据下列化合物:① NaCl ② NaOH ③ HCl ④ NH4Cl ⑤ CH3COONa ⑥CH3COOH ⑦ NH3?H2O ⑧H2O
请回答下列问题:
(1)NH4Cl溶液显 性,用离子方程式表示 ,其溶液中离子浓度大小顺序为 ;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)= ;
(3)已知水存在如下平衡:H2O+ H2O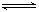 H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
| A.向水中加入NaHSO4固体 | B.向水中加Na2CO3固体 |
| C.加热至100℃[其中c(H+) = 1×10-6 mol?L-1] | D.向水中加入 (NH4)2SO4固体 |
(14分)根据下列化合物:① NaCl ② NaOH ③ HCl ④ NH4Cl ⑤ CH3COONa ⑥CH3COOH ⑦ NH3•H2O ⑧H2O
请回答下列问题:
(1)NH4Cl溶液显 性,用离子方程式表示 ,其溶液中离子浓度大小顺序为 ;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)= ;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
。
A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入 (NH4)2SO4固体
(4)若等浓度、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m n (填 “<”、“>”或“=”)。
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:____________________________________________________。
根据下列化合物:① NaCl ② NaOH ③ HCl ④ NH4Cl ⑤ CH3COONa
⑥CH3COOH ⑦ NH3•H2O ⑧H2O
请回答下列问题:
(1)NH4Cl溶液显 性,用离子方程式表示 ,其溶液中离子浓度大小顺序为 ;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)= ;
(3)已知水存在如下平衡:H2O+ H2O![]() H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入 (NH4)2SO4固体
(4)若等浓度、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m n (填 “<”、“>”或“=”)。
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:____________________________________________________。
(12分)
(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为____________。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是____________。
①0.2 mol·L-1的CuSO4溶液
②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl
④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是_________________(填序号)。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA-, HA- H++A2- 。
H++A2- 。
①则Na2A溶液显__________________(填“酸性”“中性”或“碱性”),理由是_______________________________(用离子方程式表示)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
| A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com