
题目列表(包括答案和解析)
(共10分)某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示:
由图中数据分析求:
(1)该反应的化学方程式为 。(2分)
(2)反应开始至4 min时,A的平均反应速率为 。(要求写出计算过程)(2分)
(3)第4min末时A、B的物质的量浓度依次为________(1分)、________(1分)。第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同)(2分),第8 min时,v(正)________v(逆)(2分)。
(共10分)某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示:
由图中数据分析求:
(1)该反应的化学方程式为 。(2分)
(2)反应开始 至4 min时,A的平均反应速率为 。(要求写出计算过程)(2分)
至4 min时,A的平均反应速率为 。(要求写出计算过程)(2分)
(3)第4min末时A、B的物质的量浓度依次为________(1分)、________(1分)。第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同)(2分),第8 min时,v(正)________v(逆)(2分)。
(共10分)某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示:
由图中数据分析求:

(1)该反应的化学方程式为 。(2分)
(2)反应开始至4 min时,A的平均反应速率为 。(要求写出计算过程)(2分)
(3)第4min末时A、B的物质的量浓度依次为________(1分)、________(1分)。第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同)(2分),第8 min时,v(正)________v(逆)(2分)。
(8分)在某温度下,将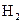 和
和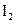 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定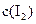 的变化,5S时测定
的变化,5S时测定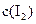 =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。
(1)反应在达到平衡过程中,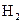 的平均消耗速率为 mol/L·S;
的平均消耗速率为 mol/L·S;
(2)反应的平衡常数的表达式是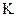 = ;
= ;
(3)此温度下,平衡常数值为 ;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。
(9分)在某温度下,将H2和I2各0.1 mol的气态混合物充入2 L的密闭容器中,充分反应,达到平衡后,测得C(HI)=0.02mol/L。
(1)求该反应的平衡常数;
(2)在上述温度下,陔容器中若通入H2和I2各4.0 mol的气态混合物,求达到化学平衡状态时各物质的浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com