
题目列表(包括答案和解析)
Ⅰ.下列说法中正确的是 。
A.SO2和O3、PO43-和ClO4-互为等电子体
B.甲烷分子失去一个H+,形成CH3-,其碳原子的杂化类型发生了改变
C.Ti原子的核外电子排布式为[Ar]3d34s2
D.CS2、H2O、C2H2都是直线形分子
E.CH4、BCl3、CO2都是含有极性键的非极性分子
Ⅱ.立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐 ,比较下列原子的第一电离能:Be B,N O(填“>”“<”),其原因是 。
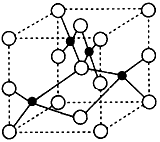
(2)如图为立方氮化硼的晶胞,则氮化硼的化学式为 ,该晶体中B原子填充N原子的 空隙。若该晶胞的边长为a cm,那么该晶体的密度为 g/cm3(只要求列出算式)。

(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因: 。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为 ,请画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
| A.SO2和O3、PO43-和ClO4-互为等电子体 |
| B.甲烷分子失去一个H+,形成CH3-,其碳原子的杂化类型发生了改变 |
| C.Ti原子的核外电子排布式为[Ar]3d34s2 |
| D.CS2、H2O、C2H2都是直线形分子 |

下列关于丙烯(CH3—CH =CH2)的说法正确的
A.丙烯分子有7个![]() 键,1个
键,1个![]() 键
键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
【解析】单键全部是![]() 键,双键是由1个
键,双键是由1个![]() 键和1个
键和1个![]() 键构成,所以丙烯分子有8个
键构成,所以丙烯分子有8个![]() 键,1个
键,1个![]() 键,A不正确。碳碳双键中的碳原子是sp2杂化,B不正确。丙烯中碳和碳之间形成的是非极性键,C正确。碳碳双键是平面型结构键角是120°的,所以3个碳原子不可能在同一直线上,D不正确。答案选C。
键,A不正确。碳碳双键中的碳原子是sp2杂化,B不正确。丙烯中碳和碳之间形成的是非极性键,C正确。碳碳双键是平面型结构键角是120°的,所以3个碳原子不可能在同一直线上,D不正确。答案选C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com