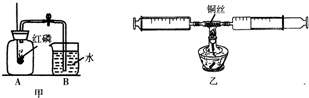
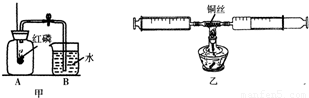
(2010?内江)(1)测定空气中氧气的体积分数可以采用图甲乙两种装置,甲装置实验过程中,红磷燃烧产生大量白烟,当温度降到室温,打开止水夹,会观察到
现象.乙装置可视为甲的改进装置,乙装置与甲装置相比较,优点在于
测量更为精确或减少污染
测量更为精确或减少污染
(任答一点).

(2)乙装置实验完后,变黑的铜丝可用稀硫酸处理得到硫酸铜.工业上制备硫酸铜通常有两种方案.
方案一:铜
氧化铜
硫酸铜
方案二:铜
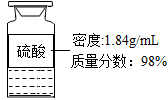
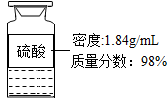
硫酸铜[Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
20]
其中方案
一
一
更适合工业生产,主要原因是
无污染大气的SO2产生或H2SO4利用率更高
无污染大气的SO2产生或H2SO4利用率更高
(任答一点).
(3)方案二产生的S0
2具有和C0
2类似的性质,都能使澄清石灰水变浑浊,除此之外,SO
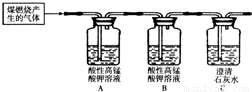
2还能被酸性高锰酸钾溶液吸收,使高锰酸钾溶液颜色由紫色变为无色.某化学兴趣小组为探究煤燃烧的气体产物,将煤燃烧产生的气体通入澄清石灰水,观察到石灰水变浑浊.
根据现象,猜想一:煤燃烧产生的气体是C0
2;
猜想二:煤燃烧产生的气体是S0
2;
猜想三:煤燃烧产生的气体是
SO2和CO2的混合气体
SO2和CO2的混合气体
.为了验证此气体成分,该小组设计了如下实验,其中B装置的作用是
检验SO2是否被除尽
检验SO2是否被除尽
;当观察到
A瓶溶液褪色,B瓶溶液不褪色,C瓶溶液出现白色沉淀或变浑浊
A瓶溶液褪色,B瓶溶液不褪色,C瓶溶液出现白色沉淀或变浑浊
现象,证明猜想三成立.


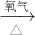 氧化铜
氧化铜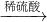 硫酸铜
硫酸铜 硫酸铜[Cu+2H2SO4(浓)
硫酸铜[Cu+2H2SO4(浓) CuSO4+SO2↑+2H20]
CuSO4+SO2↑+2H20]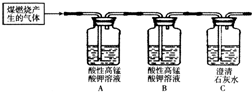
 氧化铜
氧化铜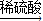 硫酸铜
硫酸铜 硫酸铜[Cu+2H2SO4(浓)
硫酸铜[Cu+2H2SO4(浓) CuSO4+SO2↑+2H20]
CuSO4+SO2↑+2H20]