
题目列表(包括答案和解析)
 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
| ||
| ||


化学实验是研究物质性质的基础.
(1)下列有关实验操作或测量数据合理的是________(填序号).
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度.
![]()
甲组方案:
试剂X从下列试剂中选择:
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 NaOH溶液
c.新制氯水d.KI溶液
①加入的试剂X为________(填字母序号),生成SO42-主要的离子方程式为________.
②甲组方案中,第ⅲ步的“系列操作”包含的操作名称各为________.
乙组方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol·L-1 KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+![]() 2Mn2++5SO42-+3H2O)
2Mn2++5SO42-+3H2O)
ⅲ.记录数据,计算.
③乙组设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)

(3)某同学制备Fe(OH)3胶体:用洁净烧杯量取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊.该同学制备胶体失败的原因是________,你认为成功制得Fe(OH)3胶体的特征现象是________.
(4)用下图装置进行CO2性质的有关实验.
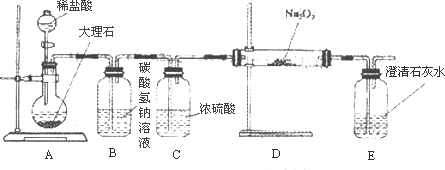
①试剂瓶B中盛有饱和NaHCO3溶液,其目的是________.
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系________.
如图某化学实验小组从商店买回的浓硫酸试剂标签的部分内容,该小组在课外资料中获得以下信息:浓硫酸腐蚀性很强,溶于水时释放大量的热,浓硫酸的硫酸分步电离。
|
向HSO4- ![]() SO42- + H+
SO42- + H+
由于试剂瓶口密封签已破损,他们怀疑该硫酸质量分数与标签不符,确定开展研究.
甲认为可以用一种精密仪器测量该溶液的C(H+),若C(H+) =36.8 mol•L-1,该溶液的质量分数为0.98;
乙认为,即使有精密的仪器,甲方案也不行,建议用重量分析法来测。具体设想:取一定体积该硫酸和足量BaCl2反应,过滤、洗涤、干燥沉淀,称量沉淀的质量
丙则建议用“中和滴定”进行测量,设想如下:A、准确量取一定体积的硫酸,并用适量的水稀释;B、往稀释后溶液中滴入2-3滴酚酞;C、用一定浓度的NaOH溶液滴定,直到出现滴定终点为止;D、记录消耗的NaOH溶液的体积。
回答下列问题:。
(1)乙推断“甲同学方案不可行”的理由是: 。
(2)乙方案的关键操作有两点:①确保SO42-完全反应,②洗涤沉淀,确保沉淀不夹杂质。在实验中如何认定SO42-完全反应?
。
(3)如何稀释浓硫酸溶液?
。
(4)丙方案下列操作会使测定结果偏大 。
①在滴定前未用NaOH标准溶液润洗滴定管
②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失
③锥形瓶用水洗干净后,未用待测液润洗
④开始时平视读数,滴定完成时俯视读数
(5)丙在实验中,分别取硫酸5.00mL,用5.00mol/L NaOH滴定三次,终点时,得到的NaOH的体积依次为35.65mL、40.62mL、35.55mL,试通过计算该硫酸是否合格.(要计算过程)
硫酸 化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对原子质量:98 密度:1.84g/cm3 质量分数:98% |
H2SO4![]() H++
H++![]()
![]()
![]() H++
H++![]()
由于该试剂瓶口密封签已破损,他们怀疑该硫酸质量分数与标签不符,决定开展研究。
甲认为可以用一种精密的仪器测量该溶液的c(H+),若c(H+)=36.8 mol/L,则该溶液的质量分数为0.98;
乙认为,即使有“精密的仪器”,甲方案也不可行,建议用“重量分析法”来测定。具体设想:取一定体积该硫酸和足量BaCl2反应,过滤、洗涤、干燥沉淀,称沉淀的质量。
丙则建议用“中和滴定”进行测量。设想如下:A.准确量取一定体积的硫酸,并用适量的水稀释;B.往稀释后溶液中滴入2—3滴酚酞;C.用一定浓度的NaOH溶液滴定,直到出现滴定终点为止;D.记录消耗的NaOH溶液的体积。回答下列问题:
(1)乙推断“甲同学的方案不可行”的理由是________________________________________。
(2)乙方案的关键操作有两点:①确保硫酸根离子完全反应;②洗涤沉淀,确保沉淀不会夹杂杂质。在实验中如何认定硫酸根离子完全反应?答:___________________________________;如何在过滤器中洗涤沉淀?答:____________________________________________________。
(3)如何稀释浓硫酸溶液? _________________________________________________________。
(4)丙在实验中,分别取硫酸5.00mL,用5.0mol/L NaOH滴定三次,终点时得到的NaOH的体积依次为35.65 mL,40.62mL,35.55 mL。试通过计算说明该硫酸是否合格。
 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com