
题目列表(包括答案和解析)
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100 mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500 mL、0.1000 mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10 mL市售白醋样品,置于100 mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00 mL于________中.
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
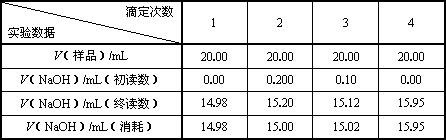
则c(样品)/moL·L-1=________;样品总酸量g / 100mL=________.
Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:
V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24 mL.
试分析他的计算是否合理,如果不合理请说明理由.
________________________________________________________________.
(2)乙同学用0.1000 mol/L NaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
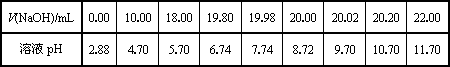
①请作出pH-V(NaOH)图.
①由表和图可知:在允许的误差范围(±0.1%)内,pH突变
(滴定突跃)范围为________.
所以可选择________作指示剂.
附:常见指示剂的变色范围

某同学用中和滴定法测定某烧碱样品的纯度,其操作步骤如下:
①称取25.0 g烧碱样品,配成1 L溶液;
②用________(填仪器名称)量取10.00 mL配制好的溶液于锥形瓶中,用0.20 mol·L-1的标准盐酸滴定(杂质不与盐酸反应),所得数据如下表,其中第2组数据读数如图所示.
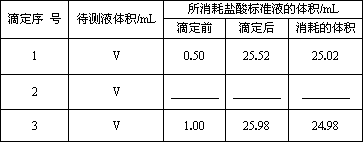
请回答下列问题:
(1)根据滴定管的读数填写上表.
(2)实验过程中,配制溶液定容时俯视刻度线会使所配溶液浓度________(填“偏大”“偏小”或“无影响”,下同);滴定前仰视液面,滴定后平视液面会使烧碱样品纯度的测量值比实际值________.
(3)三组数据中,因误差过大而应舍去的一组是第________组(填序号),根据合理数据求得该烧碱样品中NaOH的质量分数为________.
某实验小组欲比较CuO和MnO2对KClO3分解速率的影响,进行了如下实验:
(一)制取CuO
实验步骤:①称取5 g CuSO4·5H2O,研细后倒入烧杯中,加30 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀为止,然后将
所得混合物转移到蒸发皿中,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题
(1)上述实验步骤中需要使用玻璃棒的是 (填实验步骤序号),
研磨固体所用仪器的名称是
(2)步骤③中洗涤沉淀的操作方法是
(二)催化效果比较
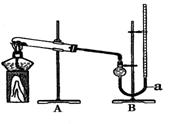 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
| 实验 | KClO3质量 | 其它物质的量 | 待测数据 |
| 实验Ⅰ | 1.2g | 无其他物质 | |
| 实验Ⅱ | 1.2g | CuO 0.5g | |
| 实验Ⅲ | 1.2g | MnO2 0.5g |
回答下列问题:
(3)上表所列实验中的“待测数据”指
(4)量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是
(填“酸式”或“碱式”)滴定管。
(5)若要证明实验Ⅱ中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管a,拔去干燥管上单孔橡皮塞,
(6)为探究CuO在实验Ⅱ中是否为催化剂,需补做如下实验(无需写出具体操作):
a. ,b.检验CuO的化学性质有没有改变。
(10分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) ,实验装置如下图(图中加热及夹持仪器略去):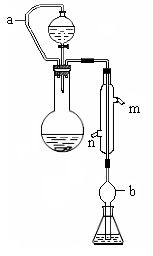
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
| 实验次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5. 01 |
| 2 | 6.00 | 10.99 |
| 3 | 12.00 | 17.60 |
| A.锥形瓶水洗后未烘干 | B.滴定过程中滴定管有漏水现象 |
| C.滴定过程中有少量溶液从锥形瓶中溅出 | D.滴定前滴定管内有气泡,滴定后没有了 |

| 实验次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5. 01 |
| 2 | 6.00 | 10.99 |
| 3 | 12.00 | 17.60 |
| A.锥形瓶水洗后未烘干 | B.滴定过程中滴定管有漏水现象 |
| C.滴定过程中有少量溶液从锥形瓶中溅出 | D.滴定前滴定管内有气泡,滴定后没有了 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com