
题目列表(包括答案和解析)

 [化学-物质结构与性质]
[化学-物质结构与性质]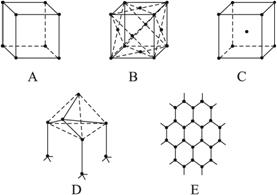
图3-28
(1)代表金刚石的是(填编号字母,下同) __________,其中每个碳原子与__________个碳原子最接近且距离相等。金刚石属于__________晶体。?
(2)代表石墨的是__________,其中每个正六边形占有的碳原子数平均为__________个。
(3)代表NaCl的是__________,每个Na+周围与它最接近且距离相等的Na+有__________个。
(4)代表CsCl的是__________,它属于__________晶体,每个Cs+与__________个Cl-紧邻。
(5)代表干冰的是__________,它属于__________晶体,每个CO2分子与__________个CO2分子紧邻。
(6)若说“离子晶体中只有离子键,分子晶体中没有化学键”是否正确?简答理由。__________________________________________
(7)NaCl晶体、HCl晶体、干冰、金刚石熔点由高而低的顺序是__________;其中在熔融或液态时能导电的电解质是__________,液态不导电但为电解质的是__________,在水溶液中能导电的非电解质是__________。
如图3-28表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。?
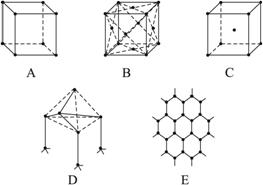
图3-28
(1)代表金刚石的是(填编号字母,下同) __________,其中每个碳原子与__________个碳原子最接近且距离相等。金刚石属于__________晶体。?
(2)代表石墨的是__________,其中每个正六边形占有的碳原子数平均为__________个。
(3)代表NaCl的是__________,每个Na+周围与它最接近且距离相等的Na+有__________个。
(4)代表CsCl的是__________,它属于__________晶体,每个Cs+与__________个Cl-紧邻。
(5)代表干冰的是__________,它属于__________晶体,每个CO2分子与__________个CO2分子紧邻。
(6)若说“离子晶体中只有离子键,分子晶体中没有化学键”是否正确?简答理由。
(7)NaCl晶体、HCl晶体、干冰、金刚石熔点由高而低的顺序是__________;其中在熔融或液态时能导电的电解质是__________,液态不导电但为电解质的是__________,在水溶液中能导电的非电解质是__________。
已知尿素的结构式为 :
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
:
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)基态Fe3+的核外电子排布式为 ;C、N、O三种元素的第一电离能由大到小的顺序是 。
(2)尿素分子中N原子的杂化方式是 。
(3)NH+4中H—N—H键角比NH3中H—N—H键角大,原因为 。
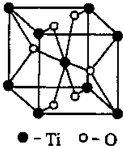
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。

①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②NaCl晶胞也为面心立方结构,已知NaCl晶体密度为 g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com