
题目列表(包括答案和解析)
实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)已知反应N2(g)+3H2(g) 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
| 化学键 | H—H | N—H | N=N |
| 键能(kJ/mol) | 436 | 391 | 945 |
 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________。 
 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。| 化学键 | H—H | N—H | N=N |
| 键能(kJ/mol) | 436 | 391 | 945 |
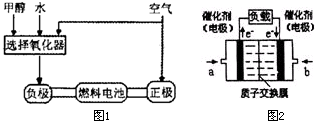 德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答:
德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com