
题目列表(包括答案和解析)
将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合。
(1)若所得混合液为中性,则a∶b=_______________。
(2)若所得混合液的pH=2,则a∶b=_______________。
(2)已知25℃时0.1 mol·L-1,醋酸溶液达到平衡(HAc![]() H++Ae-)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸,则电离平衡__________(填“向左”“向右”“不移动”)。若向原醋酸溶液加入少量醋酸钠晶体,待晶体溶解后溶液的pH值_________(填“增大”“减小”“不变”)。
H++Ae-)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸,则电离平衡__________(填“向左”“向右”“不移动”)。若向原醋酸溶液加入少量醋酸钠晶体,待晶体溶解后溶液的pH值_________(填“增大”“减小”“不变”)。
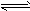 H++A2-
H++A2- (1)若所得混合液为中性,则a∶b=_____________;
(2)若所得混合液pH=2,则a∶b=_____________。
某温度(t℃)时,水的KW=10-13则该温度(填大于、等于或小于)________25℃,理由是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com