
题目列表(包括答案和解析)
(12分)多重平衡规则在未知电位的计算中起着非常重要的作用,请利用该规则完成下列问题。
1.已知:NO3-+3H++2e-=HNO2+H2O;E1θ=0.93V,Ka(HNO2)=4.6×10-4。
求:NO3-+H2O+2e-=NO2-+2OH-的E2θ值。
2.已知:a.Mg(s)+1/2O2(g)=MgO(s) ΔrG![]() =-569.44kJ/mol
=-569.44kJ/mol
b.MgO(s)+H2O(e)=Mg(OH)2(s) ΔrG![]() =-26.95kJ/mol
=-26.95kJ/mol
c.H2O(1)=H2(g)+1/2O2(g) ΔrG![]() =237.19kJ/mol
=237.19kJ/mol
d.H2O(1)![]() H+(aq)+OH-(aq) Kw=1.0×10-14
H+(aq)+OH-(aq) Kw=1.0×10-14
e.Mg(OH)2(s)=Mg2+(aq)+2OH-(aq) Ksp=5.61×10-12
求:Mg2+(aq)+2e-=Mg(s)的Eθ值。
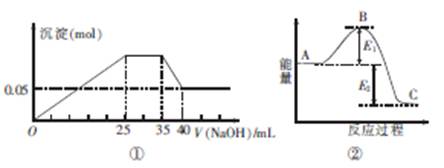
| A.图①中三种离子的物质的量之比n(Mg2+):n(Al3+):n(NH+4)=1:1:2 |
| B.图①中使用的NaOH的浓度为2 mol·L-1 |
| C.图②中若使用催化剂,B点会降低 |
| D.图②中若由物质C反应生成物质A,则反应的活化能为E1+E2 |

| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)—→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
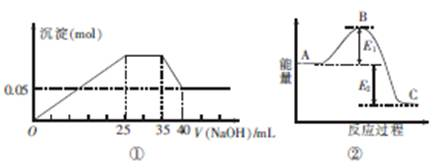
下图①表示向含MgCl2、AlCl3、NH4Cl三种物质的混合溶液中逐滴加入NaOH溶液时,沉淀的物质的量与NaOH溶液的体积关系;图②表示某反应过程中的能量关系。下列各表述与示意图不一致的是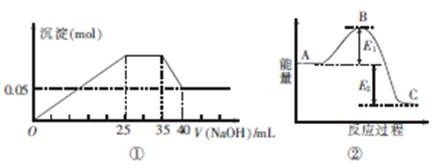
| A.图①中三种离子的物质的量之比n(Mg2+):n(Al3+):n(NH+4)=1:1:2 |
| B.图①中使用的NaOH的浓度为2 mol·L-1 |
| C.图②中若使用催化剂,B点会降低 |
| D.图②中若由物质C反应生成物质A,则反应的活化能为E1+E2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com