
题目列表(包括答案和解析)
某有机物结构简式为: —CH2—CH—COOH,它可能发生的反应有:①加成反应;
②取代反应;③缩聚反应;④水解反应;⑤中和反应;⑥显色反应;⑦氧化反应;⑧还原反应;⑨消去反应;其中正确的是( )
A.③⑤⑥⑦ B.全部 C.④⑤⑥⑦ D.除①④外其余都有
(1)“502胶”是一种快干胶,其主要成分是α氰基丙烯酸乙酯,其结构简式为:
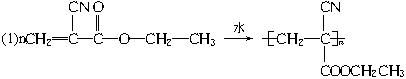 ,它在空气中微量水催化下发生加聚反应,迅速固化而将被黏物粘牢。请写出“502胶”发生黏合过程的化学方程式:________________________。
,它在空气中微量水催化下发生加聚反应,迅速固化而将被黏物粘牢。请写出“502胶”发生黏合过程的化学方程式:________________________。
(2)厌氧胶也是一种黏合剂,其结构简式为:
![]() ,它在空气中稳定,但在隔绝空气(缺氧)时分子中双健断开发生聚合而固化。工业上用丙烯酸(CH2=CH—COOH)和某种物质在一定条件下反应可制得这种黏合剂。请写出这一制取过程的化学方程式:__________。
,它在空气中稳定,但在隔绝空气(缺氧)时分子中双健断开发生聚合而固化。工业上用丙烯酸(CH2=CH—COOH)和某种物质在一定条件下反应可制得这种黏合剂。请写出这一制取过程的化学方程式:__________。
(3)乳白胶是一种常见黏合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),其中同时含有“—CHO”和“—CH=CH—”结构的同分异构体有多种,如:
“CH3—CH=CH—O—CHO”和“CH2=CH—CH2—O—CHO”,请再写出三种能稳定存在的同分异构体的结构简式(已知含有![]() 的结构不能稳定存在___________________,______________________,______________________________。
的结构不能稳定存在___________________,______________________,______________________________。
有机黏合剂是生产和生活中一类重要的材料。黏合过程一般是液态的小分子黏合剂经化学反应转化成为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分是α―氰基丙烯酸乙酯,其结构简式为:
![]() 它在空气中微量水催化下发生加聚反应,迅速固化而将被黏物粘牢。请写出“502胶”发生黏合过程的化学方程式:
它在空气中微量水催化下发生加聚反应,迅速固化而将被黏物粘牢。请写出“502胶”发生黏合过程的化学方程式:
。
(2)厌氧胶也是一种黏合剂,其结简式为:
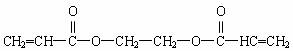
它在空气中稳定,但在隔绝空气(缺氧)时分子中双键断开发生聚合而固化。工业上用丙烯酸(CH2=CH―COOH)和某种物质在一定条件下反应可制得这种黏合剂。请写出这一制取过程的化学方程式:
(3)乳白胶是一种常见黏合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),其中同时含有“―CHO”和“―CH=CH―”结构的同分异构体有多种,如:“CH3―CH=CH―O―CHO”和“CH2=CH―CH2―O―CHO”,请再写出三种能稳定存在的同分异构体的结构简式(已知含有![]() 的结构不能稳定存在) , ,
的结构不能稳定存在) , ,
。

- 4 |
| 1000.00 mL |
| 20.00 mL |
| 10 g×20.00%-1.68 g |
| 10 g×20.00% |
| 1000.00 mL |
| 20.00 mL |
| 10 g×20.00%-1.68 g |
| 10 g×20.00% |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com