
题目列表(包括答案和解析)
(12分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________
(12分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________
(10分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是
。
(3)上图中6号元素在周期表中的位置是 ;
其原子M层电子的轨道表示式为 。
(4)上图中4,5,6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是: 。
(12分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题:
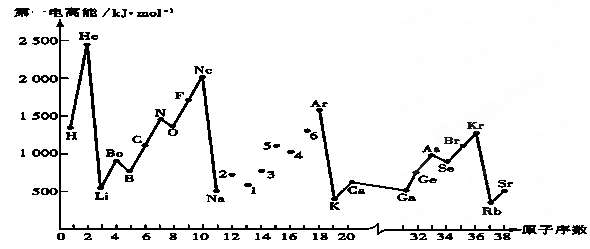
(1)同一周期元素的第一电离能从左到右总趋势是 (填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是 。(3)已知2号的I1=738KJ/mol, 则它的I2 738KJ/mol, I3 3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为( )
A.3.5 B.1.8 C.2.5 D.4.0
(5)上图中4、5、6三种元素最高价含氧酸的酸性从强到弱顺序为 _________ (用对应酸的化学式表示);它们的气态氢化物的稳定性均比同主族上一周期的元素气态氢化物弱,原因是: ______ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com