某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
2.00 |
0.00 |
| 1 |
0.90 |
1.80 |
0.20 |
| 3 |
0.75 |
1.50 |
0.50 |
| 5 |
0.65 |
1.30 |
0.70 |
| 9 |
0.55 |
1.10 |
0.90 |
| 10 |
0.55 |
1.10 |
0.90 |
| 14 |
0.55 |
1.10 |
0.90 |
(1)体系中发生反应的化学方程式是
X+2Y?2Z
X+2Y?2Z
;
(2)计算该反应在0~3min时间内产物Z的平均反应速率:
0.017mol/L?min
0.017mol/L?min
;
(3)该反应达到平衡时反应物X的转化率α等于
45%
45%
;
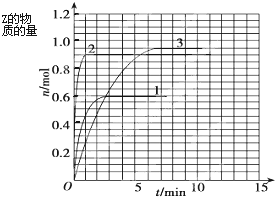
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1
升高温度
升高温度
,2
使用合适的催化剂
使用合适的催化剂
,3
增大压强
增大压强
.
(5)如果起始加入X、Y、Z的物质的量分别为2.00mol、4.00mol和0mol,在原温度下达平衡时,X的转化率为α
!,则α
!>
>
α(填<>=).
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00mol、1.00mol和1.00mol,此时可逆反应的反应速率:υ(正)
>
>
υ(逆)(填<>=).