
题目列表(包括答案和解析)
(14分)我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
(14分)我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
(14分)我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
现代工业将煤炭气化后,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以制成许多清洁能源、扩大水煤气的广泛用途。
(1)已知:①2C(s)+O2(g)=2CO(g) △H1=-221.0kJ.mol-1;
②2H2(g)+O2(g)=2H2O(g)△H2=-483.6kJ.mol-1
则反应C(s)+ H2O(g)= CO(g) + H2(g);△H=____ 。
(2)工业上有一种用CO2 来生产甲醇燃料的方法: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
 现将6.0molCO2和8.0molH2充入2L的密闭容器中,测得H2的物质的量(n)随时间变化如下图所示(实线)。
现将6.0molCO2和8.0molH2充入2L的密闭容器中,测得H2的物质的量(n)随时间变化如下图所示(实线)。
①下列时间段平均反应速率最大的是______(填序号),
A.0~1min B.1~3min
C.3~8min D.8~11min
其速率是:υ(H2)=_________ 。
② 平衡时氢气的转化率 ;该条件下
反应的平衡常数K= 。
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是_____________。
(3)某研究所组装的CH3OH—O2燃料电池的
工作原理如图所示。
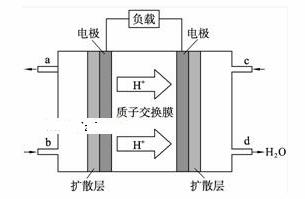
①该电池工作时,b口通入的物质为 ,
②该电池正极的电极反应式为: 。
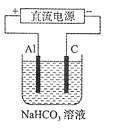 ③以此电池做电源,在实验室中模拟铝制品表面
③以此电池做电源,在实验室中模拟铝制品表面
“钝化”处理(装置右图所示)的过程中,发现溶液
逐渐变浑浊并有气泡产生,其原因可能是
(用相关的离子方程式表示):
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com