
题目列表(包括答案和解析)
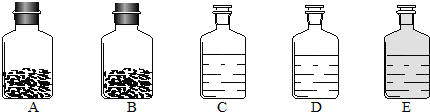
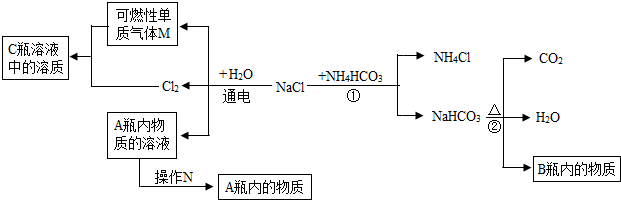
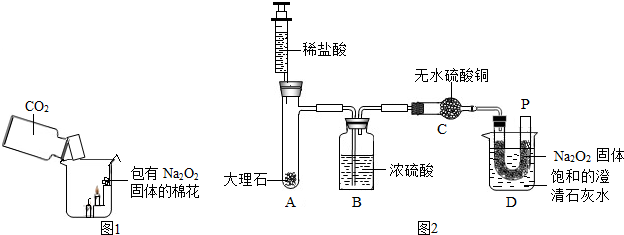
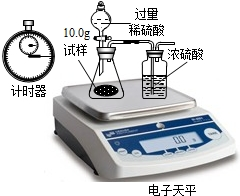
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.30 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 248.20 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 248.00 |
 大型纪录片《水问》,向人们说明了水是生命之源,万物之基,是人类最宝贵的自然资源,唤起人们认识水、了解水、关心水、爱护水、节约水的意识。
大型纪录片《水问》,向人们说明了水是生命之源,万物之基,是人类最宝贵的自然资源,唤起人们认识水、了解水、关心水、爱护水、节约水的意识。
(1)认识水,了解水的组成。
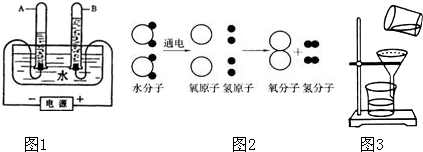
①右图是电解水的实验装置示意图,试管a中产生的气体是
▲ ;发生反应的文字表达式是 ▲ 。
②在某次电解水的实 验中加入了少量的硫酸钠溶液,测得了分别与电源正负两极相连的阳、阴两极上产生的气体的实验数据如下
验中加入了少量的硫酸钠溶液,测得了分别与电源正负两极相连的阳、阴两极上产生的气体的实验数据如下 :
:
| 时间/分钟 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积(cm3) | 6 | 12 | 20 | 29 | 39 |
| 55 | 65 | 75 | 85 |
| 阳极生成气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 24 | 29 | 34 | 39 |
 仔细分析以上实验数据,1~4分钟内阴、阳两极生成的气体体积之比大于2:l,可能的原因是 ▲ 。
仔细分析以上实验数据,1~4分钟内阴、阳两极生成的气体体积之比大于2:l,可能的原因是 ▲ 。
③右图是水分子分解的示意图,请从宏观、微观两个方面各写一条获得的化学信息。
Ⅰ. ▲
 Ⅱ. ▲
Ⅱ. ▲
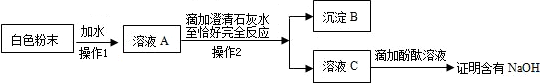
 (2)关心水、爱护水,让水更好的为人类服务,我国规定水质必须在各种指标达标后方可以成为生活饮用水。各种指标的主要要求为:a.不得呈现异色 b.不得有异味
(2)关心水、爱护水,让水更好的为人类服务,我国规定水质必须在各种指标达标后方可以成为生活饮用水。各种指标的主要要求为:a.不得呈现异色 b.不得有异味
c. 应澄清透明 d.不得含有细菌和病毒
①为达到c指标,将静置后的河水采用右图装置进行过滤,请问:图中还缺少的一种仪器是 ▲ ,若过滤后滤液仍然浑浊的可能原因是 ▲ (只要求说出一种原因)。
②为了实现a、b指标,可以利用 ▲ (填物质名称)的吸附作用而达到;
③取适量经过上述①②步骤处理后得到的水于烧杯中,加入肥皂水并搅拌,发现烧杯中泡沫较少,但有大量浮渣,则说明河水是 ▲ (填“硬水”或“软水”),日常生活中使用硬水会带来许多麻烦,家庭生活中常用来降低水的硬度的方法是 ▲ 。
④ 氮是农作物生长过程中重要的营养元素,合理的使用可以提高产量,如果施用不当是水体中含氮量超标的原因之一,可以污染水源。下图是某硝酸铵产品包装袋上的标签说明,请根据相关信息回答下列问题:
Ⅰ.NH4NO3 的相对分子质量为 ▲
Ⅱ. NH4NO3中氮、氢、氧三种元素的质量比为 ▲ 

Ⅲ.通过计算说明该袋硝酸铵产 品是混合物还是纯净物?
品是混合物还是纯净物?

| 时间/分钟 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 55 | 65 | 75 | 85 |
| 阳极生成气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 24 | 29 | 34 | 39 |
| 商品名:硝酸铵(NH4NO3) 净 重:50kg 含氮量:34% (氮元素都来自硝酸铵) ×××化工有限公司 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com