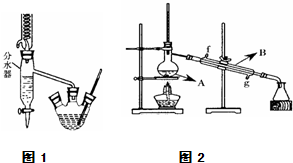
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
| 化合物 |
相对分子质量 |
密度/g?cm-3 |
沸点/℃ |
溶解度/100g水 |
| 正丁醇 |
74 |
0.80 |
118.0 |
9 |
| 冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
| 乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
请回答有关问题.
I乙酸正丁酯粗产品的制备
在三孔圆底烧瓶中装入沸石,加入18.5mL正丁醇和15.4mL冰醋酸(稍过量),再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,请写出其中一种的结构简式
CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3
CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3
.
(2)反应时加热有利于提高酯的产率,但实验发现温度过高酯的产率反而降低,可能的原因是
乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低;
乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低;
.
Ⅱ乙酸正丁酯粗产品的制备
(1)将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na
2CO
3溶液洗涤有机层,该步操作的目的是
溶解正丁醇;中和乙酸;降低乙酸正丁酯的溶解度,便于分层析出;
溶解正丁醇;中和乙酸;降低乙酸正丁酯的溶解度,便于分层析出;
.
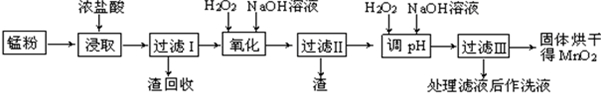
(2)将酯层采用如图1所示装置蒸馏.
①图2中仪器A、B的名称分别为
蒸馏烧瓶、冷凝管
蒸馏烧瓶、冷凝管
.
②蒸馏收集乙酸正丁酯产品时,应将温度控制在
126.1℃
126.1℃
左右.
Ⅲ计算产率
称量制得的乙酸正丁酯的质量为13.92g,则乙酸正丁酯的产率为
60%
60%
.

 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
 CaO2+2HCl
CaO2+2HCl CaO2+2HCl
CaO2+2HCl