
题目列表(包括答案和解析)
 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaC1O;氯气与热的氢氧化钠溶液反应可生成NaC1O和NaC1O3。②在酸性较弱时KI只能被NaC1O氧化,在酸性较强时亦能被NaC1O3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为 (填“阳极”或“阴极”)。生成NaClO的离子方程式为 。
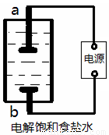
(2)该小组将0.784 L(标准状况)Cl2通入50.00 mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0 mL。
①取稀释后的溶液25.00 mL用醋酸酸化,加入过量KI溶液。用0.2000 mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00 mL时恰好到达终点。
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00 mL。
①操作②中氯酸钠与碘化钾反应的离子方程式为 。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为 。
③计算氢氧化钠溶液的物质的量浓度。
某活动课程小组拟用
50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程________、________.
此方案第一步的实验装置如下图所示:

(2)加入反应物前,如何检查整个装置的气密性________.
(3)装置B中盛放的试剂是________,作用是________.
(4)在实验室通常制法中,装置A还可作为下列________气体的发生装置(填序号).
①CH2![]() CH2
CH2
②H2S
③CH4
④CH≡CH
⑤H2
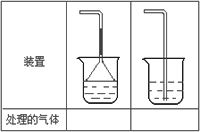
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内.
(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com