
题目列表(包括答案和解析)
在容积固定的4L密闭容器中进行可逆反X(g)+2Y(g) 2Z(g),并达到平衡,在此过程中以Y的浓度改变表示的反应速率V(正)、V(逆)与时间t的关系如下图。图中阴影部分的面积表示
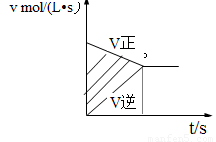
A、X的浓度的减少 B、Y的物质的量的减少
C、Z的浓度的增加 D、X的物质的量的减少
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X原子核外有两种形状的电子云,四种伸展方向,常温下以双原子分子存在,性质稳定;Y的单质是生活中常见的合金材料成分之一,原子核外只有一个未成对电子,Z原子的半径比X大,其基态原子最外层的p电子是该层s电子的两倍,W是最常见的黑色金属之一。
(1)Z位于元素周期表中的位置是 ,W3+的最外层电子排布式是______,X的氧化物XO2与H2O比较,熔点较高的是______ (填化学式)。
(2)加热条件下,Z的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成 Z的最髙价含氧酸,写出此反应的化学方程式 。.
(3)比较Y、W性质的活泼性 (用一个化学反应方程式表示)。
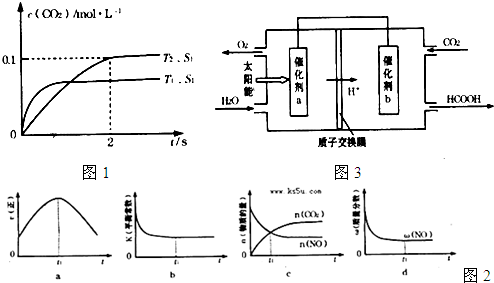
(4)2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒PM2.5。汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
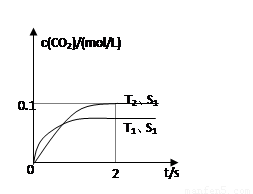
据此判断:
该反应为 反应(放热、吸热);在T2温度下,0~2s内的平均反应速率:υ(N2)= ;
(5)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,
在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(6)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量和质量)
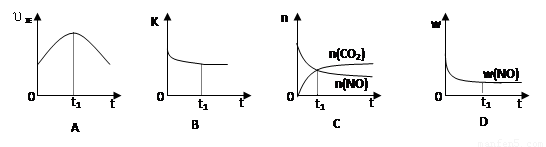
在容积固定的4L密闭容器中进行可逆反X(g)+2Y(g) 2Z(g),并达到平衡,在此过程中以Y的浓度改变表示的反应速率V(正)、V(逆)与时间t的关系如下图。图中阴影部分的面积表示
A、X的浓度的减少 B、Y的物质的量的减少
C、Z的浓度的增加 D、X的物质的量的减少
| A、A为0.4mol/L、O2为0.2mol/L | B、A为0.25mol/L | C、A、B均为0.15mol/L | D、B为0.4mol/L |
| 催化剂 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com