
题目列表(包括答案和解析)
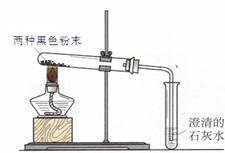
同学们在帮助老师整理实验室时,从1、2号橱窗中发现了两瓶失去标签的黑色粉末药品,并确定了这两瓶黑色粉末是木炭粉、铁粉、氧化铜、高锰酸钾中的两种。他们继续进行了分析、试验和反思:
【查阅资料】 CuO、Fe2O3等金属氧化物与酸反应,生成盐和水
(1)分析:小燕同学认为一定不是高锰酸钾,原因是__________________________________;
(2)实验一:
| 实验操作 | | |
| ①取一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末溶解,溶液颜色变_________ | 此粉末是氧化铜 |
| ②取另一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末不溶解,没看到气体产生 | 此粉末一定不是铁粉 |
化学课外活动小组的同学们在帮助老师处理用大理石制取二氧化碳实验后的废液时,发现实验桌上有一瓶标签缺损的Na2CO3溶液,他们决定利用该废液测定Na2CO3溶液中溶质的质量分数。他们的测定方法是:取一定量的废液放入烧杯中,向烧杯中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀的质量关系如右图所示。
(1) 向废液中加入Na2CO3时生成的沉淀是________________。
(2) 在向废液中加入Na2CO3溶液的过程中,开始时没有沉淀生成而有气体生成,说明废液中的溶质除CaCl2外,还有_________________。
(3) 计算Na2CO3溶液中溶质的质量分数。

| ||
| △ |

| ||
| ||
| 实验组别 | 实验操作 | 实验现象 | 结论 |
| 实验1 | 取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热. 向冷却后的固体中加入足量的稀盐酸. |
黑色粉末变成 红 红 色固体部分溶解,有气泡产生,水溶液呈无色. |
Zn和CuO能发生置换反应. |
| 实验2 | 取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热. 向冷却后的固体中加入足量的稀盐酸. |
发生爆炸,黑色粉末变成红色. 固体部分溶解,有气泡产生,水溶液呈 无 无 色. |
镁与氧化铜能发生置换反应 镁与氧化铜能发生置换反应 |
| 实验3 | 取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热. | 粉末无变化 | Cu、Fe2O3不能反应. |
| 白色粉末的成分 | 形成的原因 |
| 可能是 CaCO3 CaCO3 |
石灰水与空气中CO2反应生成的沉淀 |
| 可能是 Ca(OH)2 Ca(OH)2 |
暑假气温较高,溶质的溶解度降低或溶剂蒸发, 石灰水中的溶质析出 |
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取上述试管中的上层清液, 滴加1~2滴无色酚酞试液 |
不变色 | 没有Ca(OH)2 没有Ca(OH)2 |
| 往上述试管内残留的固体中加入稀盐酸 | 有气泡 有气泡 |
白色粉末中有CaCO3 |
| 由上述实验可知白色粉末的成分是: 只有CaCO3 只有CaCO3 . | ||
| 实验内容 | 可能观察到的现象 | 结论 |
| 取白色粉末装入试管中,加入少量的水振荡后静置,取试管中的上层清液,滴加1~2无色酚酞试液 | 白色粉末中有 Ca(OH)2 | |
| 取上述试管中的残留的固体,加入稀盐酸 | 有气泡产生 | 白色粉末中有 CaCO3 |
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com