
题目列表(包括答案和解析)
| ||
| ||


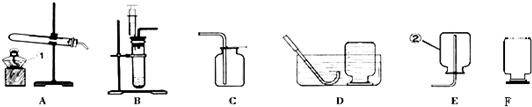
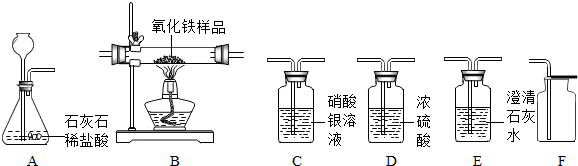
根据下列实验装置示意图,请回答下列问题:
(1)写出标号①的仪器名称:① ;
(2)实验室用氯酸钾和二氧化锰的混合物制取O 2的化学方程式为 ;收集![]() O2的装置可选择 (填
O2的装置可选择 (填![]() 字母)。完全反应后的固体残渣,通过以下四步实验操作可回收得到较纯净的二氧化锰(残渣中只有二氧化锰难于水)。正确操作的先后顺序是 (填写选项符号)。
字母)。完全反应后的固体残渣,通过以下四步实验操作可回收得到较纯净的二氧化锰(残渣中只有二氧化锰难于水)。正确操作的先后顺序是 (填写选项符号)。
a.烘干 b.溶解 c.过滤 d.洗涤
分离得到的二氧化锰在反应前后 保持不变。
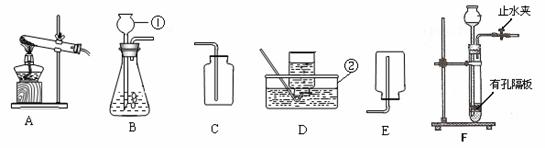
(3)在实验室用大理石和稀盐酸制取CO2的实验装置中,F装置相对于B装置具有的优点是 ;
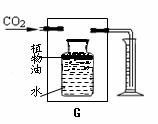
图G所示装置可用来测量生成CO2的体积,其中在水面
上放一层植物油的目的 ;![]()
请在图G方框内 画出补充的仪器,完成测量生成![]() CO2的体积装置
CO2的体积装置
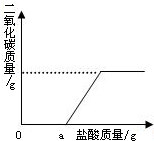
(用黑色水笔画图)。取25克大理石与足量的稀盐酸完全反应, 收集到二氧化碳为8.8克,求参加反应的碳酸钙为多少摩尔?并求该大理石中碳酸钙的质量分数?(杂质不与酸反应)(写出计算过程) 。
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 26.5克 | 148.5克 | 146.3克 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com