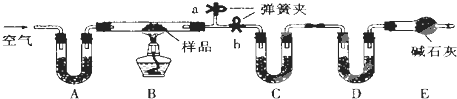
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO
2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
C+
K
2Cr
2O
7+
→
CO
2↑+
K
2SO
4+
Cr
2(SO
4)
3+
H
2O
请完成并配平上述化学方程式.
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H
2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H
2(g)?CH
3OH(g)△H
1=-116kJ?mol
-1①下列措施中有利于增大该反应的反应速率的是
;
A、随时将CH
3OH与反应混合物分离
B、降低反应温度
C、增大体系压强
D、使用高效催化剂
②已知:
CO(g)+O2(g)=CO2(g)△H
2=-283 kJ?mol
-1H2(g)+O2(g)=H2O(g)△H
3=-242 kJ?mol
-1则表示1mol气态甲醇完全燃烧生成CO
2和水蒸气时的热化学方程式为
;
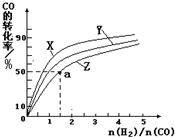
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H
2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
;
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H
2(g)?CH
3OH(g) 的平衡常数K=
.
(3)CO
2在自然界循环时可与CaCO
3反应,CaCO
3是一种难溶物质,其Ksp=2.8×10
-9.CaCl
2溶液与Na
2CO
3溶液混合可形成CaCO
3沉淀,现将等体积的CaCl
2溶液与Na
2CO
3溶液混合,若Na
2CO
3溶液的浓度为7×10
-4mol/L,则生成沉淀所需CaCl
2溶液的最小浓度为
.


 (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: