
题目列表(包括答案和解析)

氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是:
。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组
2CaSO4+2Cl2↑+2H2O。某学习小组
利用此原理设计如图所示装置制取氯气并探究其性质。
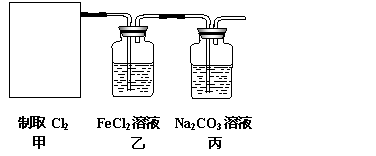
①在该实验中,甲部分的装置是 (填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。
证明FeCl2与Cl2发生了氧化还原反应的实验方法是
。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
④该实验存在明显的缺陷,改进的方法是 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 === Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为 。
氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是:
。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组
2CaSO4+2Cl2↑+2H2O。某学习小组
利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是 (填字母)。
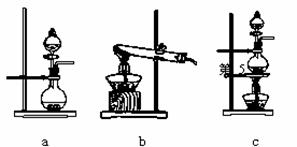

②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。
证明FeCl2与Cl2发生了氧化还原反应的实验方法是
。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
④该实验存在明显的缺陷,改进的方法是 。
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的某种原子没有中子;Y与X相邻,Y与Z也相邻,X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高。 试回答下列问题:
(1)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,写出其中两种离子发生反应生成其中两种分子的离子方程式 。
(2)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,试写出该反应化学方程式 。
(3)由W、X、Y、Z四种元素的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式 。
(4)由元素X和Z可组成A、B、C、D四种中学化学常见的单质或化合物,四种物质之间存在如右图所示的转化关系。
①写出A与B反应生成C的化学方程式 。

②向50mL 4mol·L-1的NaOH溶液中通入1.12L气体B(标准状况),反应后溶液中溶质的物质的量之比为
。
(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3。该盐溶液中离子浓度由大到小的顺序为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com