
题目列表(包括答案和解析)
| A、该反应属于置换反应 | B、该反应中氧化剂是CO,还原剂是NO2 | C、该反应生成14gN2时,转移8mole- | D、该反应能减少汽车尾气对环境的污染 |
| ||
. |
A、
| ||
B、
| ||
C、
| ||
D、
|
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
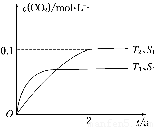
据此判断:
①该反应的ΔH________0(填“>”或“<”)
②在T2温度下,0~2 s内的平均反应速率v(N2)=______________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填代号)。
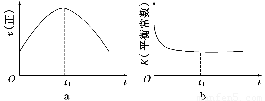
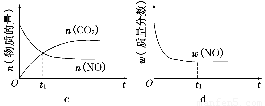
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)??N2O4(g) ΔH2=-56.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:________________________________________________________________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的
目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为__________________________。
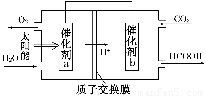
③常温下,0.1 mol·L-1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=________。
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) ===4N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
下列说法正确的是
A.反应CO4(g)+2NO2(g) ===N2(g)+CO2(g)+2H2O(l)的ΔH=-867 kJ·mol-1
B.若用CH4还原0.2mol NO2至N2,在上述条件下放出的热量为173.4 kJ
C.若用CH4还原l mol NOx为N2的过程中,若x=1.6,则生成0.4mol CO2
D.若用标准状况下2.24LCH4还原NOx至N2,整个过程中转移电子0.4 mol
一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
下列叙述正确的是
A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(l) ΔH=-867 kJ·mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol
C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com