
题目列表(包括答案和解析)
5KCl+KClO3+3H2O。

请回答下列问题:
(1)B中的液体是________,其作用是________________________________________;
(2)已知C杯中装的是水,D管内装的是15mL30%KOH溶液,这种水浴加热方法的优点是________________,通过什么现象可以观察到KOH基本反应完毕___________________
__________________。
(3)E处管口塞着一团棉纱(已用Na2S2O3溶液浸湿),作用是利用其还原性吸收多余的Cl2,反应的离子方程式为________________________。
(4)已知KCl和KClO3在水中的溶解度如下表:
温度/℃ 0 20 40 60 80 100
KCl/℃ 27.6 34 40 45 51.1 56.7
KclO3/g 3.3 7 14 24.5 38.5 57
待D管内KOH基本反应完时,取所得混合溶液直接加热浓缩,则首先从溶液中析出的晶体是________________,当蒸发适量水后,趁热过滤,然后将滤液冷却,这时析出的晶体主要是________________________,欲进一步提纯KClO3,应采用的方法是________________
____________________。
实验室制KClO3,可利用下图装置。实验中的化学原理是利用MnO2和浓盐酸制得氯气,然后使氯气与热的KOH溶液(约70℃)反应制KClO3,其化学方程式为:3Cl2+6KOH![]()
5KCl+KClO3+3H2O。

请回答下列问题:
(1)B中的液体是________,其作用是________________________________________;
(2)已知C杯中装的是水,D管内装的是15mL30%KOH溶液,这种水浴加热方法的优点是________________,通过什么现象可以观察到KOH基本反应完毕___________________
__________________。
(3)E处管口塞着一团棉纱(已用Na2S2O3溶液浸湿),作用是利用其还原性吸收多余的Cl2,反应的离子方程式为________________________。
(4)已知KCl和KClO3在水中的溶解度如下表:
温度/℃ 0 20 40 60 80 100
KCl/℃ 27.6 34 40 45 51.1 56.7
KclO3/g 3.3 7 14 24.5 38.5 57
待D管内KOH基本反应完时,取所得混合溶液直接加热浓缩,则首先从溶液中析出的晶体是________________,当蒸发适量水后,趁热过滤,然后将滤液冷却,这时析出的晶体主要是________________________,欲进一步提纯KClO3,应采用的方法是________________
____________________。
(9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水稀释。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 → A→ → →D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
|
滴定序号 |
待测稀硫酸的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
|
V1 |
V2 |
||
|
① |
20.00 |
0.50 |
22.60 |
|
② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
(9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水稀释。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 →A→ → →D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
| 滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
| V1 | V2 | ||
| ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:
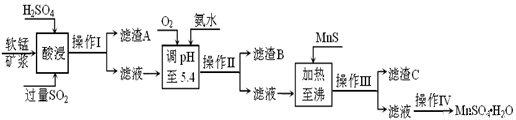
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。


图1: SO2 的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com