
题目列表(包括答案和解析)
铁、铜及其化合物应用广泛,如FeCl3可用作印刷电路铜板腐蚀剂和外伤止血剂等;CuCl2可用作消毒剂、媒染剂、催化剂;硫酸铁可用作电化浸出黄铜矿精矿工艺。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 ;
(2)催化剂的应用已有多年的历史,在现代化学工业中的应用十分普遍。下列物质中可以用做催化剂加速双氧水分解的是 ;
①FeCl3 ②CuCl2 ③MnO2 ④CuSO4
(3)黄铜矿精矿工艺在阳极浸出的反应比较复杂,其中有一步主要的化学反应为:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为![]() 2价)当有1mol CuFeS2参加反应时,转移的电子有 mol。
2价)当有1mol CuFeS2参加反应时,转移的电子有 mol。
(4)已知A由氧化铜和氧化亚铜混合而成。X为一种常见的酸,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去。
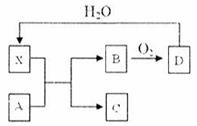
①X的化学式为 ;
②写出B转化为D的化学方程式 ;
③X使蔗糖变黑这一现象,体现了X的 性;
④若混合物A中Cu的质量分数为85%,则混合物中氧化铜和氧化亚铜的物质的量之比为
| A.可以用FeCl3溶液区别出苯酚溶液、乙醇、苯 |
| B.向淀粉溶液中加入少量稀硫酸,加热一段时间后,加入新制的Cu(OH)2悬浊液,加热,无砖红色沉淀生成,则说明淀粉未发生水解 |
| C.判断油脂皂化反应基本完成的方法是用胶头滴管吸取少量混合液体加入到蒸馏水中,未发生分层现象,则说明油脂皂化反应基本完成 |
| D.电解精炼铜的实验中,当阴极流入2mol电子时,阳极溶解了64gCu |
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 ??????? 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡?????? 移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH=???? (不考虑溶液的体积变化)。
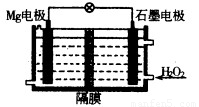
(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是???? 。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
(3)NaHS可作为沉淀剂除去溶液中的Cu2+。常温下,NaHS溶液显碱性,原因是??????????????????? (用离子方程式和必要的文字说明)。向含有Cu2+的废水中加入少量NaHS固体,废水溶液的pH?????? (填“增大”“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com