
题目列表(包括答案和解析)
有机物A、B、C互为同分异构体,分子式均为C5H8O2,有关的转化关系如下图所示。已知:

①A
单质Ag;
②B为含有一个五元环的酯;
③CH3—CH===CH—R![]() CH2BrCH===CHR
CH2BrCH===CHR
请回答下列问题:
(1)C中不含氧的官能团的名称是 ,D转化为C的反应类型______________。
(2)B、H的结构简式依次为 、 。
(3)F的加聚反应产物的结构简式为 。
(4)E不能发生反应的反应类型有 (填序号,多选、漏选或错选均不得分)。
①取代反应 ②加成反应 ③银镜反应 ④水解反应 ⑤消去反应 ⑥聚合反应 ⑦氧化反应 ⑧还原反应 ⑨皂化反应 ⑩酯化反应
(5)写出E→F的反应方程式(只写①条件下的反应,有机物用结构简式表示):
。
(6)M是D的同分异构体,且符合以下条件:①分子中只含有一个甲基(—CH3);②能发生银镜反应;③1 mol M与足量Na反应能产生标准状况下22.4 L的气体;④除官能团上的氢原子外,还有两种不同类型的氢原子。请任意写出一种符合条件的M的结构简式:
。
的碳链无支链,且0.1 mol A能与足量Ag(NH3)2OH完全反应可得到43.2 g(9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水稀释。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 → A→ → →D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
|
滴定序号 |
待测稀硫酸的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
|
V1 |
V2 |
||
|
① |
20.00 |
0.50 |
22.60 |
|
② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
(22分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)(3分)写出制取乙酸乙酯的化学反应方程式(有机物用结构简式表示):
(2)(3分)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:先在试管中加入一定量的 ,然后边加边振荡试管将 加入试管,冷却后再加入 。

(3)(4分)浓硫酸的作用是:① ;② 。
(4)(3分)饱和碳酸钠溶液的主要作用是 。
(5)(2分)在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
(6)(2分)若要把制得的乙酸乙酯分离出来,应采用的实验操作叫 。
(7)(2分)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的 。
(8)(3分)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化。
(22分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)(3分)写出制取乙酸乙酯的化学反应方程式(有机物用结构简式表示):
(2)(3分)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:先在试管中加入一定量的 ,然后边加边振荡试管将 加入试管,冷却后再加入 。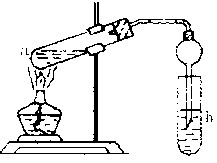
(3)(4分)浓硫酸的作用是:① ;② 。
(4)(3分)饱和碳酸钠溶液的主要作用是 。
(5)(2分)在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
(6)(2分)若要把制得的乙酸乙酯分离出来,应采用的实验操作叫 。
(7)(2分)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的 。
(8)(3分)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化。
(9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水稀释。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 →A→ → →D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
| 滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
| V1 | V2 | ||
| ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com