
题目列表(包括答案和解析)
某混合金属粉末,除Fe外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在,探究过程如下:
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
甲同学基于假设③设计实验方案如下:
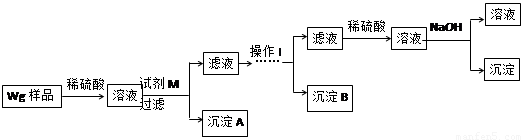
乙同学同样基于假设③设计另一实验方案如下:
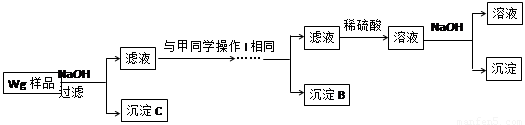
(1)Fe元素在周期表中的位置是第 周期 族。
(2)试剂M是 ;沉淀B是 。
(3)你认为甲、乙同学的方案 (填“甲”或“乙”)比较好,理由是 。
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为 (填“是”或“否”)准确,原因是 。
(6)电解法制金属铝的化学方程式是 。
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
某混合金属粉末,除Fe外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在,探究过程如下:
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
甲同学基于假设③设计实验方案如下: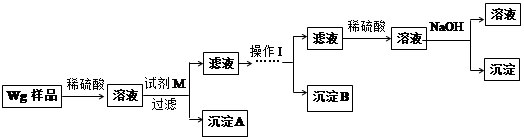
乙同学同样基于假设③设计另一实验方案如下: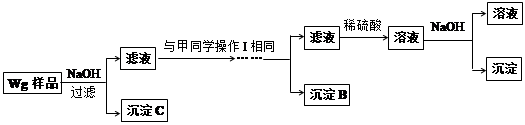
(1)Fe元素在周期表中的位置是第 周期 族。
(2)试剂M是 ;沉淀B是 。
(3)你认为甲、乙同学的方案 (填“甲”或“乙”)比较好,理由是 。
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为 (填“是”或“否”)准确,原因是 。
(6)电解法制金属铝的化学方程式是 。
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com