
题目列表(包括答案和解析)
氮元素的化合价态较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气生成.下面介绍的甲、乙两位学生设计的两种制备少量氮气的不同实验方案的示意框图(箭头表示气体流向).试回答下列问题:

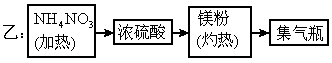
(1)甲、乙两位学生的实验方案是否能制得氮气?甲________、乙______(填“能”或“不能”)
(2)若不能制得氮气,请具体说明原因,并指出纠正的办法(如两种方案都能制得氮气,此小题不要回答).
(3)甲方案中所用的碱石灰是否可换成浓硫酸?请说明理由.
(4)甲、乙两位同学若按正确操作制得氮气,在相同条件下,用密度法测出的氮气相对分子质量为材Mr(精确到0.001),若进行比较,有 (甲)________
(甲)________ (乙)(填“大于”、“等于”或“小于”).
(乙)(填“大于”、“等于”或“小于”).
氮元素的化合价态较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气生成.下面介绍的甲、乙两位学生设计的两种制备少量氮气的不同实验方案的示意框图(箭头表示气体流向).试回答下列问题:


(1)甲、乙两位学生的实验方案是否能制得氮气?甲________、乙______(填“能”或“不能”)
(2)若不能制得氮气,请具体说明原因,并指出纠正的办法(如两种方案都能制得氮气,此小题不要回答).
(3)甲方案中所用的碱石灰是否可换成浓硫酸?请说明理由.
(4)甲、乙两位同学若按正确操作制得氮气,在相同条件下,用密度法测出的氮气相对分子质量为材Mr(精确到0.001),若进行比较,有 (甲)________
(甲)________ (乙)(填“大于”、“等于”或“小于”).
(乙)(填“大于”、“等于”或“小于”).
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |


氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
a.2v(H2)正=3v(NH3)逆 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡向_____方向移动。
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)______ Ksp(AgBr)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式_________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com