
题目列表(包括答案和解析)
(16分)化学发展史上,有许多偶然事件引起科学发现的事例,碘的发现也得益于Courtoris对意外现象的注意。碘是人类发现的第二个生物必需微量元素,它以碘化物形式存在于海水、海藻及人体甲状腺中。人类缺碘会引起甲状腺肿大,我国已全面实施加碘盐方案。
3-1 单质碘的制备方法之一是在酸性条件下通Cl2于NaI溶液中,指出运用该法时应注意的问题?分析其原因,写出有关反应方程式。
3-2 在100%硫酸中,I2可被HIO3氧化成I3+,写出配平的离子方程式。
3-3 为什么在日照强、温度高的海区,表层水碘浓度往往要低一些?
3-4 人体缺碘会影响正常的生命活动。儿童缺碘会造成身体畸形,智力低下。成年人缺碘会因新陈代谢能力降低而导致全身无力,提早出现衰老现象。为提高人体素质,食物补碘已引起人们的重视。据报道,人从食物中摄取碘后便在甲状腺中积存下来,通过一系列化学反应形成甲状腺素。甲状腺素的结构:
(1)写出甲状腺素的化学式 ;
(2)在甲状腺内,甲状腺素的主要合成过程如下:
A(氨基酸)![]() B
B![]() 甲状腺素+C(氨基酸)
甲状腺素+C(氨基酸)
请写出A、B、C的结构简式。
3-5 科研表明,人的一生只要能摄入一小茶匙的碘就能正常发育,健康生活。目前预防缺碘的有效办法是食用含碘食盐。目前国内食盐加碘加的主要是碘酸钾。
(1)写出工业上以KI为原料制备碘酸钾的化学方程式;
(2)如何用简易操作检验食盐是否加碘。写出离子反应方程式。
3-6 已知反应H2+I2![]() 2HI,分两步完成I2
2HI,分两步完成I2![]() 2I H2+2I
2I H2+2I![]() 2HI
2HI
式中k,k1,k2,k3是分别为各反应相应的速率常数,若用Ea,E1,E2,E3分别表示各反应相应的活化能,请找出Ea和E1,E2,E3间的关系。已知公式如下:
①对于反应aA+bB→eE+f F,反应速率为:v=k[A]a[B]b
②速率常数与活化能之间满足阿仑尼乌斯公式:k=Ae-Ea/RT
③对于反应I2![]() 2I满足:v正=v逆
2I满足:v正=v逆
| A.化学反应速率可用某时刻生成物的物质的量来表示 |
| B.在同一反应中,用反应物或生成物表示的化学反应速率的值是相等的 |
| C.化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加 |
| D.可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率 |
下列关于化学反应速率的说法中正确的是( )。
| A.化学反应速率可用某时刻生成物的物质的量来表示 |
| B.在同一反应中,用反应物或生成物表示的化学反应速率的值是相等的 |
| C.化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加 |
| D.可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率 |
(13分)Ⅰ.(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______(填序号)。
①1mL 0.01 mol?L—1的碘水 ②1mL 0.001 mol?L—1的碘水
③4mL 0.01 mol?L—1的Na2S2O3溶液 ④4mL 0.001 mol?L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32—)=_______________。
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) 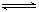 CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L—1)变化如下:
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L—1)变化如下:
| | 0min | 5min | 10min |
| CO | 0.01 | | 0.0056 |
| H2O | 0.01 | | 0.0156 |
| CO2 | 0 | | 0.0044 |
| H2 | 0 | | 0.0044 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com