
题目列表(包括答案和解析)
(12分)某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
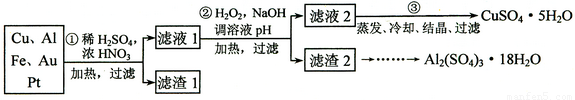
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程式______________ 。
⑵ 第②步加H2O2的作用是_______________;调溶液pH的目的是使____________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
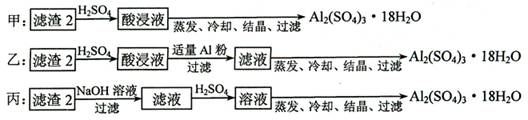
上述三种方案中,_______方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下:

已知:
|
离子 |
溶液pH值 |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Fe3+ |
2.7 |
3.7 |
|
Cu2+ |
5.2 |
6.4 |
(1).写出A→B过程中发生反应的离子方程式为 。
(2).溶液C中加入稀硫酸调至pH=1的目的是________________________________________。
(3).如欲检验溶液C中的杂质是否除净,其操作是 。
(4).蒸发至__________(填写现象),然后经过冷却结晶、过滤、洗涤、 (填写操作),得到纯净的蓝色晶体。
(5).为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、 、 、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.58816 g。
(6).该样品的纯度为___________。如果样品的实际纯度为93.2%,则测定的相对误差为__________。
(12分) 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:
方案乙:
(1)两个方案中,符合当前生产中绿色化学理念的是方案 ,理由是 。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________________,
若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为: ︰ 。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。
通过计算测知该晶体的化学式是 。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:
Fe 3++CuCl=Fe 2++Cu2++Cl-,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下: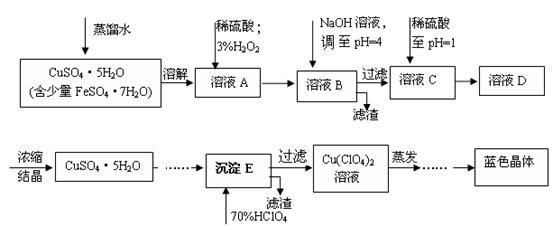
已知:
| 离子 | 溶液pH值 | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 5.2 | 6.4 |
(12分)某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: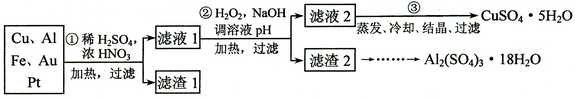
请回答下列问题:
⑴第①步Cu与酸反应的离子方程式______________ 。
⑵第②步加H2O2的作用是_______________;调溶液pH的目的是使____________生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
⑷由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: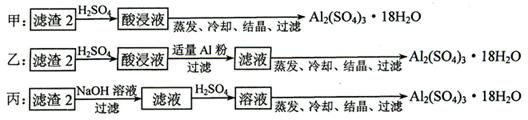
上述三种方案中,_______方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2-= CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com