
题目列表(包括答案和解析)
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
用砂纸擦后的镁带丐沸水反应,再向反应后溶液中滴加酚酞溶液向新制的H2S饱和溶液中滴加新制的氯水钠与润滴有酚酞的冷水反应镁带与2mol·L-1盐酸反应铝条与2mol·L-1盐酸反应向ALCI3溶液中滴加NaOH溶液至过量
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
某课外实验小组利用稀硫酸与金属铁反应探究影响化学反应速率的因素,得到如下实验数据:
![]()
| 实验
| 铁的
| 铁的
| c/(H2SO4)
| V(H2SO4)
| 溶液温度/℃ | 金属消失
| |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 50 |
![]() 分析上述数据,回答下列问题:
分析上述数据,回答下列问题:
![]() (1)实验2和3表明, 对反应速率有影响,影响规律是
(1)实验2和3表明, 对反应速率有影响,影响规律是
![]() ;
;
![]() (2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
![]() (3)本实验中影响反应速率的其他因素还有 ,能体现该影响因素的实验序号是 ;
(3)本实验中影响反应速率的其他因素还有 ,能体现该影响因素的实验序号是 ;
![]() (4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。
(4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。
![]() 原因是
原因是
![]() ;
;
![]() (5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因
![]() 。
。
(Ⅰ)(6分)现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)(4分)
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白
醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)左图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,
A处的刻度为25,滴定管中液面读数应为 mL。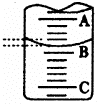
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次
所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实
验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5题目:化学电池在通讯、交通及日常生活中有着广泛的应用。
前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O ![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
(1)已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,放电就是使用电池的过程,充电是给电池补充电量的过程。以下说法中正确的是
① 以上反应不属于置换反应 ② 以上反应是复分解反应
③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
(3)另一种常用的电池是锂电池(它是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电板材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用的时间可长达十年。它的负极用金属锂制成;电池总反应可表示为:Li+MnO2→LiMnO2试回答:锂电池比容量特别大的原因是
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因
(4)下图是废弃镍钢电池中的重金属渗入水体后,进入人体的一条途径:
生物体D中重金属浓度 (大于、等于、小于)生物体A中重金属浓度,这是通过食物链 作用所引起的。除上述途径外,被污染水体中的重金属还可以直接通过 (途径)_________进入人体。
(5)下图是两个电池外壳上的说明文字某型号进口电池
某型号进口电池 | 某型号国产电池 |
| GNY 0.6(KR-AA) |
上述进口电池的电动势是 伏。上述国产电池最多可放出 毫安时的电量;若该电池平均工作电流为0.03安,则最多可使用 小时。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com