
题目列表(包括答案和解析)
| ||
| ||
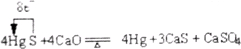
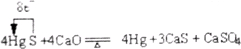
(10分)常温下,如果取0.1mol·L-1的HA溶液与0.1mol·L-1的NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合液的PH=8,试回答以下问题:
(1)混合溶液的PH=8的原因 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1mol·L-1NaOH溶液中由水电离出的c(H+)(填“>”“ <”或“=”)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字)
c(Na+)-c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH (填“大于”“小于”或“等于”)7;将同温度下等浓度的四种盐溶液:A、NH4HCO3 B、NH4A C、(NH4)2SO4 D、NH4Cl,按PH由大到小的顺序排列是 (填字母)。
(10分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。
第二份加足量NaOH溶液加热后,收集到0.08 mol气体。
第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g.。
根据上述实验,回答以下问题:
(1) 由第一份进行的实验推断该混合物是否一定含有Cl-
(2) 由第二份进行的实验得知混合物中应含有 离子,其物质的量浓度为
(3) 由第三份进行的实验可知12.54g沉淀的成分为
请计算形成该沉淀的原混合物中各离子的物质的量。(要求写出计算过程)
(4) 综合上述实验,你认为以下结论正确的是
A. 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K+) ≥0.04mol
B. 该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C. 该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D. 该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl-
(包括2小题,满分共10分)
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是_______________________(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:

⑴写出电解时发生反应的化学方程式: ;
⑵除去ClO2中的NH3可选用的试剂是 ;(填序号)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
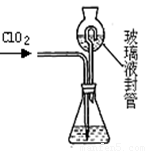
⑶测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:______________________________ (用化学方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com