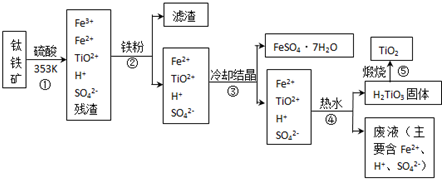
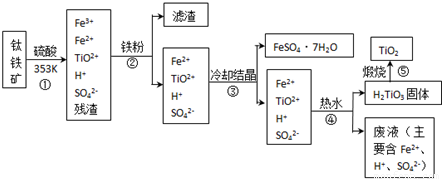
(2012?海淀区一模)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示.钛铁矿主要成分为钛酸亚铁(FeTiO
3),其中一部分铁元素在风化过程中会转化为+3价.
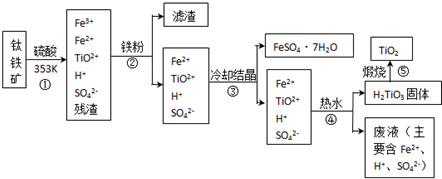
已知:TiOSO
4遇水会水解.
(1)步骤②中,用铁粉将Fe
3+转化为Fe
2+的反应的离子方程式为
2Fe3++Fe═3Fe2+
2Fe3++Fe═3Fe2+
.
(2)步骤③中,实现混合物的分离是利用物质的
b
b
(填字母序号).
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是
过滤
过滤
(填操作名称).
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO
2+转化为H
2TiO
3的原理:
溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加入热水稀释、升温后,
平衡正向移动,生成H2TiO3.
溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加入热水稀释、升温后,
平衡正向移动,生成H2TiO3.
.
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO
2)反应生产硫酸锰(MnSO
4,易溶于水),该反应的离子方程式为
MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O
MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O
.
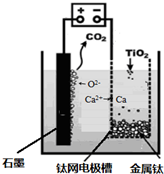
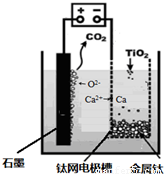
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF
2-CaO作电解质,利用如下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.
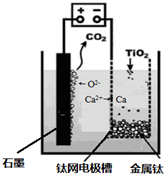
①写出阳极所发生反应的电极反应式:
2O2--4e-═O2↑
2O2--4e-═O2↑
.
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)
制备TiO
2时,在电解槽发生如下反应:2CaO═2Ca+O
2↑,2Ca+TiO
2Ti+2CaO,由此可见,CaO的量不变;
制备TiO
2时,在电解槽发生如下反应:2CaO═2Ca+O
2↑,2Ca+TiO
2Ti+2CaO,由此可见,CaO的量不变;
.