
题目列表(包括答案和解析)
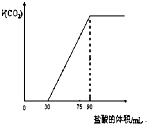 取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是( )
取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是( )| A、原NaOH溶液中通入CO2后,所得溶液中c(CO32-)小于c(HCO3-) | B、NaOH溶液中,Na+的物质的量浓度为0.18mol/L | C、NaOH溶液中通入CO2后,再加入足量盐酸产生CO2气体体积(标准状况)1344mL | D、0-30mL之间的离子方程式:CO32-+H+═HCO3- |
取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是
| A.原NaOH溶液中通入CO2后,所得溶液中c(CO32-)小于C(HCO3-) |
| B.NaOH溶液中,Na+的物质的量浓度为0.18 mol/L |
| C.NaOH溶液中通入CO2后,再加入足量盐酸产生CO2气体体积(标准状况)1344mL。 |
| D.0—30mL之间的离子方程式:CO32-+H+→HCO3- |

| A.原NaOH溶液中通入CO2后,所得溶液中c(CO32-)小于C(HCO3-) |
| B.NaOH溶液中,Na+的物质的量浓度为0.18 mol/L |
| C.NaOH溶液中通入CO2后,再加入足量盐酸产生CO2气体体积(标准状况)1344mL。 |
| D.0—30mL之间的离子方程式:CO32-+H+→HCO3- |
 取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是
取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是取A、B两份物质的量浓度相等的NaOH溶液,体积均为50mL,分别向其中通入一定量的CO2 后,再分别稀释为100mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
(2)在稀释后的溶液中分别逐滴加入0.1mol·L-1 的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如右图所示:
① 分别加入足量的盐酸后,溶液中的溶质是 ,
原NaOH溶液的物质的量浓度是 。
② A曲线表明,NaOH溶液通入CO2后,所得溶液中的溶质
是 ,与盐酸反应产生CO2的最大体积是 mL(标准状况)。
③ B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为 , 其物质的量之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com