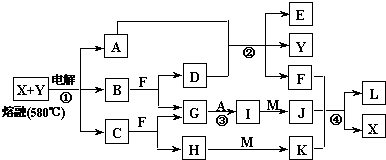
如图表示各物质之间的转化关系,A、B、C、G为单质,其中A、G为气体,F为液体.②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,常用作干燥剂,M是一种两性化合物,L是一种白色胶状沉淀.
试回答下列有关问题:
(1)M的化学式
Al2O3
Al2O3
.
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的:
降低X、Y熔化时的温度,节约能源
降低X、Y熔化时的温度,节约能源
;工业生产中,还常常利用电解X和F的混合物制取
Cl2、H2和NaOH
Cl2、H2和NaOH
.(填化学式)
(3)反应②的化学方程式是
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.
(4)反应④的离子反应方程式是
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.
(5)用化学方程式表示E在空气中失效的反应原理
Ca(ClO)
2+CO
2+H
2O=CaCO
3↓+2HClO 2HClO
2HCl+O
2↑
Ca(ClO)
2+CO
2+H
2O=CaCO
3↓+2HClO 2HClO
2HCl+O
2↑
.

