(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
(1)氨和铵盐在粮食的增产中发挥着极其重要的作用,同时又是重要的工业原料.
①写出实验室制取氨气的化学方程式:
2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O
;
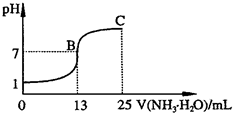
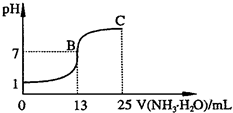
②常温下,向25mL 0.1mol?L
-1HA溶液中逐滴加入0.2mol?L
-1NH
3?H
2O溶液,曲线如图所示(体积变化忽略不计).由图确定HA是
强
强
(填“强”或“弱”)酸,HA与NH
3?H
2O恰好完全反应时,混合溶液中由水电离出的c(H
+)
>
>
(填“>”、“>”或“=”)0.1mol?L
-1HA溶液中由水电离出的c(H
+);写出C点时混合溶液中各离子浓度由大到小的顺序为
c(NH4+)>c(A-)>c(OH-)>c(H+)
c(NH4+)>c(A-)>c(OH-)>c(H+)
;
(2)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是氮化物A.粉末状A能够与水反应,所得产物中有一种酸性氧化物,它是工业上生产玻璃的主要原料,另一种产物是氨气.请写出A与水反应的化学方程式
Si3N4+6H2O=3SiO2+4NH3↑
Si3N4+6H2O=3SiO2+4NH3↑
;
(3)硝酸是医药、军事、化工等领域的重要原料.在实验室中,将适量铁铜混合粉末与稀硝酸充分反应后得到溶液X.若有固体剩余,实验测得溶液X中大量存在的阳离子只有两种,则阳离子为
Fe2+、Cu2+
Fe2+、Cu2+
(写离子符号);若反应后无固体剩余,某同学认为X中除Fe
3+、Cu
2+外还可能含有Fe
2+,若要确认其中的Fe
2+,应选用
c
c
(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.酸性KmnO
4溶液 d.浓氨水.

 (2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
 氮的化合物在某些领域中扮演着重要的角色.
氮的化合物在某些领域中扮演着重要的角色.