
题目列表(包括答案和解析)
(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)A的化学式为 。
(2)写出反应V的化学方程式 。
(3)写出反应VI的离子方程式为 。
(4)本工艺中可以循环利用的物质是(刚化学式表示) 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)A的化学式为 。
(2)写出反应V的化学方程式 。
(3)写出反应VI的离子方程式为 。
(4)本工艺中可以循环利用的物质是(刚化学式表示) 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下: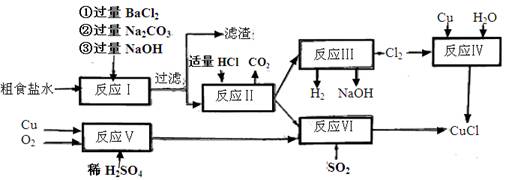
(1)反应I中加Na2CO3溶液的作用是 。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为 。
(3)①写出反应V的化学方程式
②写出反应VI的离子反应方程式 。
(4)在整个合成过程中可以循环利用的物质是
(5)反应IV加入的Cu必须过量,其目的是 。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是  。
。
(12分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)A的化学式为 。
(2)写出反应V的化学方程式 。
(3)写出反应VI的离子方程式为 。
(4)本工艺中可以循环利用的物质是(用化学式表示) 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 、 。
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:


根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是______________、氯碱工业的装置是_____________________。
(2)写出生产过程中X__________? Y___________ (填化学式)
(3)写出产生CuCl的化学方程式________________________________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是______________________________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是__________________________。
(6)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
_____________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2????? Fe2+ + Ce4+ = Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 |
空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com