
题目列表(包括答案和解析)
| 催化剂 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| 实验 编号 |
T(℃) | NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 280 |
1.20×10-3 1.20×10-3 |
1.20×10-3 1.20×10-3 |
124 |
| Ⅲ | 350 | 5.80×10-3 5.80×10-3 |
5.80×10-3 5.80×10-3 |
124 |
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | ρ(MPa) | ||
| 1 | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
| 1 |
| 3 |
| 1 |
| 3 |
 2CO2+N2
2CO2+N2| 实验编号 | T/℃ | NO初始浓度 mol?L-1 |
CO初始浓度 mol?L-1Com] |
催化剂的比表面积 ㎡?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
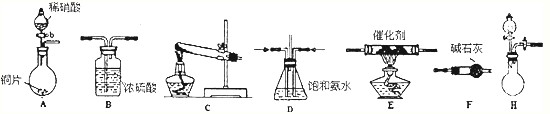
| 试剂组合序号 | 固体试剂(g) | NH3体积(ml) | |
| a | 12.0gCa(OH)2(过量) | 10.8gNH4Cl | 2688 |
| b | 10.8g(NH4)2SO4 | 2728 | |
| c | 12.0gNaOH(过量) | 10.8gNH4Cl | 3136 |
| d | 10.8g(NH4)2SO4 | 3118 | |
| e | 12.0gCaO(过量) | 10.8gNH4Cl | 3506 |
| f | 10.8g(NH4)2SO4 | 3584 | |
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com