
题目列表(包括答案和解析)
实验室中盐酸的用途十分广泛,常常用来制备气体。
(1)某小组同学欲用4 mol/L的盐酸配制230 mL 0.4mol/L 盐酸溶液,需取用4 mol/L盐酸 mL,实验中需要用到的玻璃仪器有 、 、量筒、 烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)(16分)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气。已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。( 3Cl2+6KOH ![]() KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )
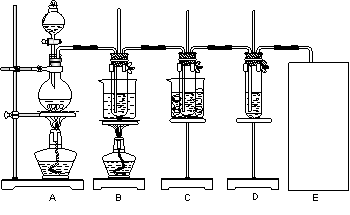 |
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式 。
(2)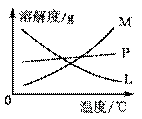 反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
(4)请在装置图方框中画出缺少的实验装置,并注明试剂。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v (CO2)表示的反应速率为 (取小数二位,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
 |
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。
A.Mg2+B.Fe2+??????????????????? C.Al3+D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
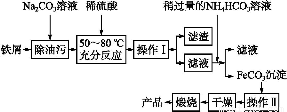
回答下列问题:
①操作Ⅰ的名称是 ,操作Ⅱ的名称是 。
②写出在空气中煅烧FeCO3的化学方程式 。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
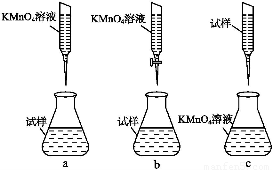
②某同学设计的下列滴定方式,最合理的是 。(夹持部分略去)(填字母序号)
③写出滴定过程中反应的离子方程式: 。
④计算上述样品中FeSO4·7H2O的质量分数为 。
Ⅰ.已知:温度过高时,WO2(s)转变为WO2(g):
![]()
![]()
则![]() 的?H=______________。
的?H=______________。
Ⅱ.1100℃时,在体积为2L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g).
(1)下列能判断该反应达到平衡状态的条件是 。
A、容器中压强不变 B、混合气体密度不变
C、1molH-H键断裂的同时形成2molH-O键 D、H2的体积分数不变
(2)若2min时反应达到平衡,此时气体质量增加了8g,则用H2表示该反应的化学反应速率为 。
(3)某温度下该反应达到平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为 。
(4)若降低温度,K值减小,则反应的△H (填“>”或“<”)0。
(5)若反应达平衡后,向体系中加入少量的H2,则反应再次达平衡后,H2?O(g)的体积分数 (填“增大”、“减小”或“不变”)。
Ⅲ、某500mL电解溶液中含0.1molNaCl和0.1molCuSO4。在恒定电流的情况下进行电解,2min后阴极开始产生气体,5min时停止电解,此时两极产生的气体体积理论上相同。
①写出此过程中阳极的电极反应式________________,
_____________________________。
②将溶液稀释为1000ml后,所得溶液的pH为 。
Ⅳ、在0.1 的CrCl3 溶液中加氢氧化钠溶液,有Cr(OH)3沉淀产生,常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH―)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
|
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制过程中,需要使用的仪器是(填写代号)________。
A.烧杯 B.量筒 C.1000 mL容量瓶 D.托盘天平
E.药匙 F.500 mL容量瓶 G.胶头滴管 H.玻璃棒
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1—2cm处
④在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线 D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为 mol/L。
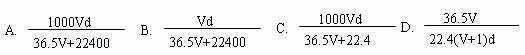
(5)现将100mL0.5mol/L的盐酸和200mL0.1mol/LCuCl2溶液混合,体积变化忽略不计,所得溶液中Cl-的物质的量浓度是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com