
题目列表(包括答案和解析)
实验室进行某项实验并检验反应产物的装置如图。

实验现象记录如下:①黑色氧化铜粉末变为光亮红色;②无水硫酸铜粉末变蓝色;③集气瓶中收集到一种无色气体。
请回答下列问题:
(1)虚线框内是否应添加必要的干燥装置 (填”是”或”否”)。若需要,应选择的干燥装置是 (填编号,若不需要,该空可不填)
(2)上图中,盛放浓氨水的仪器名称是 ,最终集气瓶中收集到的气体是 。
(3)CuO粉末处发生的化学反应方程式为 。
(4)实验室制取氨气有多种方法,写出使用”固—固加热型”装置制取氨气的化学方程式为 。
(5)简述把浓氨水加到碱石灰上能够产生氨气的原因: 。
我们接触化学已有一月有余,知道了实验室制取气体的发生装置和收集装置有如下一些:
一、气体发生装置
在初中化学里,根据反应物状态和反应条件(是否需加热),主要掌握两种发生装置。
①固―固加热型如图A1;②固―液不加热型如A2或A3。

A1 A2 A3
二、气体的收集装置
气体的收集装置选择依据气体的水溶性和密度。
①凡难溶或不溶于水且不跟水发生反应的气体可用排水法收集,如图B1。
②比空气密度大的气体可用向上排空气法收集,如图B2。
③比空气密度小的气体可用向下排空气法收集,如图B3。

(1)小明同学用双氧水和二氧化锰混合来制取氧气,他应写出的文字表达式或化学方程式为___________,在这个反应中二氧化锰是_______,选择的发生装置是_____(填序号),能用B2收集的原因是___________。
(2)氨气是一种无色、有刺激性气味,极易溶于水,密度比空气小的气体。小玲用加热氯化铵和碱石灰(均为固体)的方法制取氨气,小玲应选择的发生装置是____和收集装置是____(填序号)。若用图F装置收集氨气,氨气应从____端进入(选填“a”或“b”,下同)。若用图F装置收集氧气,氧气应从____端进入。现小丁同学想收集一定体积的氧气,她将F装置装满水后气体应从______端进入;另外还需要增加什么仪器________。
(3)实验室存放的双氧水久置后容易分解而变稀。小丁同学向盛5%双氧水溶液(久置)的试管中加入少量二氧化锰,然后将带火星的木条伸入试管,未见木条复燃。你认为带火星的木条未复燃的原因是________。要使带火星的木条复燃,可对该实验作怎样的改进? ________。
(4)小燕同学用A3装置制取了一瓶无色无味的气体Y(纯净物),请按要求填写下表:

实验室进行某项实验并检验反应产物的装置如图。

实验现象记录如下:①黑色氧化铜粉末变为光亮红色;②无水硫酸铜粉末变蓝色 ③集气瓶中收集到一种无色气体。
请回答下列问题:
(1)虚线框内是否应添加必要的干燥装置? (填“是”或“否”)。若需要,应选择的干燥装置是 (填编号,若不需要,该空可不填)
(2)上图中,盛放浓氨水的仪器名称是 ,最终集气瓶中收集到的气体是 。
(3)CuO粉末处发生化学反应方程式为 。
(4)实验室制取氨气有多种方法,写出使用“固—固加热型”装置制取氨气的化学方程式 。
(5)简述把浓氨水加到碱石灰上能够产生氨气的原因:
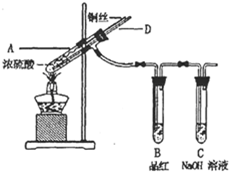 (2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.
(2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.
| ||
| ||
| ||
| ||
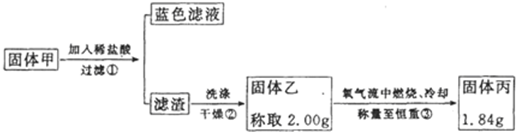
| (m-132n) |
| 42 |
| (m-132n) |
| 42 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com