
题目列表(包括答案和解析)
(共8分) XeO3是一种不稳定的物质,具有强氧化性。
2(1)配平反应的离子方程式:
XeO3 Mn
Mn H2O → MnO
H2O → MnO Xe↑
Xe↑ H
H
(2)反应现象为:①有气泡产生,② 。
(3)发生氧化反应的物质是 。
(4)将适量的XeO3投入 mL 0.1mol·L
mL 0.1mol·L Mn
Mn 的水溶液中,刚好完全反应。
的水溶液中,刚好完全反应。
此时转移电子 mol。
将反应后的溶液稀释至90mL,所得溶液的pH 。
。
(共8分) XeO3是一种不稳定的物质,具有强氧化性。
2(1)配平反应的离子方程式:
XeO3 Mn
Mn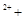 H2O → MnO
H2O → MnO Xe↑
Xe↑ H
H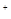
(2)反应现象为:①有气泡产生,② 。
(3)发生氧化反应的物质是 。
(4)将适量的XeO3投入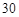 mL 0.1mol·L
mL 0.1mol·L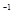 Mn
Mn 的水溶液中,刚好完全反应。
的水溶液中,刚好完全反应。
此时转移电子 mol。
将反应后的溶液稀释至90mL,所得溶液的pH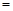 。
。
测定海水中溶解氧的步骤如下:
①水样的固定:取a mL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡均匀,使之充分反应。
②酸化:开塞后迅速加适量1∶1硫酸,再迅速塞好瓶塞,反复振荡至沉淀完全溶解。
③滴定:向溶液中加入1 mL 0.5%的淀粉溶液,再用b mol•L-1 Na2S2O3标准溶液滴定至溶液刚好褪色。
有关的离子反应如下:
2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
I![]() +2S
+2S![]() O
O![]() =2I-+S
=2I-+S![]() O
O![]()
请回答下列问题:
(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果 (填偏高、偏低或无影响),原因是 。
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果 (填偏高、偏低或无影响),原因是 。
(3)滴定前,未排除滴定管中的气泡,在滴定过程中气泡排除,会使测定结果 (填偏高、偏低或无影响),原因是 。
(4)滴定时消耗了V mL Na2S2O3标准溶液,则水中溶解O2(g/L)的量的计算式为 。
①水样的固定:取a mL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡均匀,使之充分反应。
②酸化:开塞后迅速加适量1∶1硫酸,再迅速塞好瓶塞,反复振荡至沉淀完全溶解。
③滴定:向溶液中加入1 mL 0.5%的淀粉溶液,再用b mol•L-1 Na2S2O3标准溶液滴定至溶液刚好褪色。
有关的离子反应如下:
2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
I![]() +2S
+2S![]() O
O![]() =2I-+S
=2I-+S![]() O
O![]()
请回答下列问题:
(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果 (填偏高、偏低或无影响),原因是 。
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果 (填偏高、偏低或无影响),原因是 。
(3)滴定前,未排除滴定管中的气泡,在滴定过程中气泡排除,会使测定结果 (填偏高、偏低或无影响),原因是 。
(4)滴定时消耗了V mL Na2S2O3标准溶液,则水中溶解O2(g/L)的量的计算式为 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com