
题目列表(包括答案和解析)
(每空1分,共10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 ;另一种只由B组成的离子与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)D单质晶体堆积为____________________。用●表示D原子,在方框内画出其晶胞图。

(每空1分,共10分)
已知化合物A中各元素的质量分数分别是C:37.5%,H:4.2%和O:58.3%,请填空:
(1)0.01mol A在空气中充分燃烧需消耗氧气1.01L(标准状况),则A的分子式是 ;
(2)实验表明:A不能发生银镜反应。1 mol A与足量的碳酸氢钠溶液反应可以放出3 mol CO2。在浓硫酸催化下,A与乙酸可发生酯化反应。核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境,则A的结构简式是 ;
(3)在浓硫酸催化和适宜的的反应条件下,A与足量的乙醇反应生成B(C12H20O7),B只有两种官能团,其数目比为3∶1,则由A生成B的反应类型是 ,该反应的化学方程式是 ;
(4)A失去1分子水后形成化合物C,写出C的两种可能的结构简式及其官能团的名称:① , , ;
② , , 。
(共10分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO
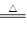 N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
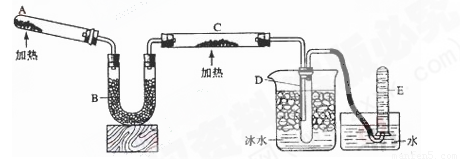
(1)A中发生反应的化学方程式是 。检验氨气通常采用的方法及现象是_________ ____________, 。
(2)B中加入的物质是 ,其作用是 。
(3)实验时C中观察到的现象是 ,该反应中氨的作用是_______剂。
(4)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,第一个干燥管X内装有_____________,现象是___________________;第二个干燥管Y内装有碱石灰,作用是____________________________。
(共10分)已知合成氨反应为:N2+ 3H22NH3,在一定温度下,向2L密闭容器中,加入2molN2和5molH2,一定条件下使之反应,经过2min后达到平衡状态并测得NH3为0.4mol,求:
(1)以N2表示这2min内该反应的反应速率?
(2)此时氢气的转化率?
(3)平衡时NH3的体积分数?(保留1位小数)
(4)平衡时容器中的压强与开始压强之比?
(5)平衡时容器中气体的平均摩尔质量?
(共10分)已知合成氨反应为:N2 + 3H2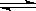 2NH3,在一定温度下,向2L密闭容器中,加入2molN2和5molH2,一定条件下使之反应,经过2min后达到平衡状态并测得NH3为0.4mol,求:
2NH3,在一定温度下,向2L密闭容器中,加入2molN2和5molH2,一定条件下使之反应,经过2min后达到平衡状态并测得NH3为0.4mol,求:
(1)以N2表示这2min内该反应的反应速率?
(2)此时氢气的转化率?
(3)平衡时NH3的体积分数?(保留1位小数)
(4)平衡时容器中的压强与开始压强之比?
(5)平衡时容器中气体的平均摩尔质量?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com