
题目列表(包括答案和解析)
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)
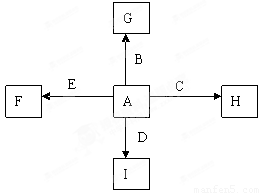
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键 (填“离子”或 “极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色
(15分)以下是元素周期表的一部分,根据给定的元素回答下列问题

(1)K的元素符号是 ;
(2)D元素的外围电子排布图是 ,在其化合物中,最高正价是 ;
(3)C元素的原子结构示意图是 ;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是 分子(填极性或非极性),B与L(1:1)的化合物的电子式是 ;
(5)G、H、L原子的第一电离能由高到低的顺序是 (填元素符号);
(6)J单质的一种白色同分异构体的空间构型是 ;
(7)E元素在元素周期表中的位置是 ,在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是 ;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是 ;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式 ;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是
。
(15分)以下是元素周期表的一部分,根据给定的元素回答下列问题
(1)K的元素符号是 ;
(2)D元素的外围电子排布图是 ,在其化合物中,最高正价是 ;
(3)C元素的原子结构示意图是 ;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是 分子(填极性或非极性),B与L(1:1)的化合物的电子式是 ;
(5)G、H、L原子的第一电离能由高到低的顺序是 (填元素符号);
(6)J单质的一种白色同分异构体的空间构型是 ;
(7)E元素在元素周期表中的位置是 ,在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是 ;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是 ;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式 ;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是
。
(9分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为 ;化合物BA4的电子式为 .
(2)化合物Y2X2中含有的化学键类型有________(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物Y2X2和A2X反应的化学方程式
(4)请用电子式表示Y2Z的形成过程_________________________.
(9分)A、B、C、D是中学化学中常见的四种短周期元素。已知①A具有多种同素异形体,A元素原子最外层电子数是次外层电子数的2倍。②B元素最高正价为 + 5。③C元素有多种化合价,且常温下C元素的单质与某种一元碱溶液反应,可得到两种含C元素的化合物。④B、C两种元素质子数之和是A元素质子数的4倍。⑤D是地壳中含量第二的元素,它的单质是一种良好的半导体材料。
(1) 写出A元素的名称_________和C离子的结构示意图____________。
(2) 工业上利用A的单质来制备单质D,请写出相应的方程式:
________________________________________________________________________。
(3) 由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种见的漂白性物质和一种能使石蕊试纸变蓝的气体。则X的分子式 。X分子中B、C原子间的化学键的类型为___________(填“极性键”或“非极性键”)。X与水反应的化学方程式________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com