
题目列表(包括答案和解析)
| 名称 | 结构简式 | 常温时的状态 | 熔点/℃ | 沸点/℃ | 相对密度 |
| 甲烷 | CH4 | 气 | -182.5 | -161.5 | |
| 乙烷 | CH3CH3 | 气 | -182.8 | -88.6 | |
| 丙烷 | CH3CH2CH3 | 气 | -188.0 | -42.1 | 0.5005 |
| 戊烷 | CH3(CH2)3CH3 | 液 | -129.7 | 36.0 | 0.5572 |
| 癸烷 | CH3(CH2)8CH3 | 液 | -29.7 | 174.1 | 0.7298 |
| 十七烷 | CH3(CH2)15CH3 | 固 | 22 | 302.2 | 0.7767 |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
(6分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸()发生化
|
(1)甲一定含有的官能团的名称是 。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中
不含甲基,且为链状结构,其结构简式是
(3)苯氧乙酸有多种同分异构体,写出任意一种含苯环结构的同分异构体的结构简式
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
|
名称 |
托盘天平 (带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
|
|
|
|
|
|
|
序号 |
a |
b |
c |
d |
e |
f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
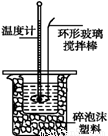
(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
|
温度 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差 平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.6 |
|
|
2 |
27.0 |
27.4 |
27.2 |
31.2 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
①上表中的温度差平均值为 ℃
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g乙醇燃烧生成CO2和液态水时放热29.7kJ。则表示乙醇燃烧热的热化学方程式为_____________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热
量_________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com