
(2012?南京二模)碘酸钙[Ca(IO
3)
2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.
几种盐的溶解度(g/100g水)
温 度/℃
物质 |
0 |
10 |
20 |
40 |
60 |
80 |
| KIO3 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
| KCl |
28.1 |
31.2 |
34.2 |
40.1 |
45.8 |
51.3 |
| CaCl2 |
59.5 |
64.7 |
74.5 |
128 |
137 |
147 |
| Ca(IO3)2 |
0.119(5℃) |
0.195(15℃) |
0.307(25℃) |
0.520 |
0.621 |
0.669 |
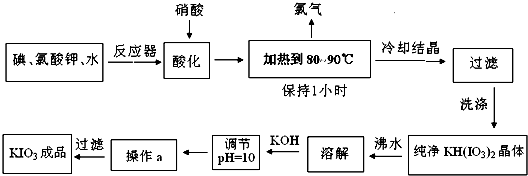
(1)实验室制备碘酸钙的实验步骤如下:
步骤1:在100mL圆底烧瓶中依次加入2.20g 碘、2.00g 氯酸钾和45mL水,加热、搅拌,使氯酸钾溶解.
步骤2:滴加6mol/L盐酸至pH=1,按如图所示组装仪器,保持水浴温度85℃左右,发生反应:
I
2+2KClO
3+HCl═KIO
3+HIO
3+KCl+Cl
2↑
步骤3:将反应液转入150mL 烧杯中,加入A溶液,调节溶液pH=10.
步骤4:用滴定管加10mL 1mol/L CaCl
2溶液,并不断搅拌.
步骤5:反应混合物先用水冷却,再在冰水中静置10分钟,过滤,用少量冰水洗三次,再用少量无水乙醇洗涤一次,抽干后,将产品转移到滤纸上,晾数分钟,得碘酸钙产品.
①步骤2中反应温度不能太高的原因是
温度过高,碘升华,KIO3分解,影响产率
温度过高,碘升华,KIO3分解,影响产率
.
②步骤3中A溶液是
KOH溶液或Ca(OH)2 溶液
KOH溶液或Ca(OH)2 溶液
.
③步骤4中实验现象是
出现浑浊
出现浑浊
有沉淀生成
有沉淀生成
.
④步骤5中在冰水中冷却静置的目的是
使Ca(IO3)2沉淀完全
使Ca(IO3)2沉淀完全
.再用无水乙醇洗涤的目的是
乙醇易挥发可加快干燥
乙醇易挥发可加快干燥
.
(2)测定产品中碘酸钙含量的实验步骤如下:
准确称取产品a g(约0.6g),置于100mL烧杯中,加1:1高氯酸20mL,微热溶解试样,冷却后移入250mL 容量瓶中,用水稀释至刻度,摇匀,得试液.
准确量取所得试液50.00mL 置于250mL 碘量瓶中,加入1:1高氯酸2mL,3g 碘化钾,盖上瓶塞,在暗处放置3 分钟,加50mL 水,用浓度为0.1000mol/L Na
2S
2O
3标准溶液滴定至浅黄色,加入 2mL 0.5%淀粉溶液,继续滴定至终点,读数.
滴定过程中发生的反应如下:
Ca(IO
3)
2+2HClO
4═2HIO
3+Ca(ClO
4)
2,IO
3-+5I
-+6H
+═3I
2+3H
2O,I
2+2S
2O
32-═2I
-+S
4O
62-①准确量取50.00mL试液的玻璃仪器是
酸式滴定管或移液管
酸式滴定管或移液管
.
②滴定至终点的现象是
溶液蓝色消失,且半分钟内不恢复
溶液蓝色消失,且半分钟内不恢复
.
③为准确获得样品中Ca(IO
3)
2的含量,还需补充的实验是
重复测定两次
重复测定两次
.

 (2012?南京二模)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.
(2012?南京二模)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.