
题目列表(包括答案和解析)
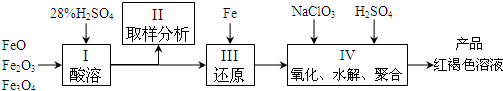
(2012?信阳一模)下列实验操作与预期实验目的或所得实验结论一致的是( )
|
(8分)(1)(3分)下列各组物质中: ③H2O和 D2O ④ CH3CH3 和CH3CH2CH2CH3 ⑤ CH3-CH2-OH和CH3-O-CH3
互为同位素的是;____ __; 互为同素异形体是:____ __;
互为同分异构体是:___ ___。
(2)(5分)利用氧化还原反应原理配平以下化学方程式,并填空:
FeSO4 + KNO3+ H2SO4=== K2SO4+ Fe2(SO4)3+ NO↑+ H2O
①氧化产物为
②当电子转移了0.3mol时,有 g氧化剂参加反应
(8分)(1)(3分)下列各组物质中: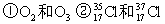 ③H2O和 D2O ④ CH3CH3 和CH3CH2CH2CH3
⑤ CH3-CH2-OH和CH3-O-CH3
③H2O和 D2O ④ CH3CH3 和CH3CH2CH2CH3
⑤ CH3-CH2-OH和CH3-O-CH3
互为同位素的是;____ __; 互为同素异形体是:____ __;
互为同分异构体是:___ ___。
(2)(5分)利用氧化还原反应原理配平以下化学方程式,并填空:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
①氧化产物为
②当电子转移了0.3mol时,有 g氧化剂参加反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com